癌症疫苗的分类、进展及未来临床转化中的挑战
原创:彪彪 来源:生物制品圈
摘要:癌症疫苗作为免疫治疗的关键组成部分,分为预防性和治疗性两类。预防性疫苗(如HPV和HBV疫苗)通过阻断致癌病毒感染显著降低癌症发病率,而治疗性疫苗通过激活树突状细胞(DC)和细胞毒性T淋巴细胞(CTL)诱导持久的抗肿瘤免疫应答。近年来,合成肽、mRNA、DNA、细胞疫苗及纳米疫苗等平台的创新显著提升了抗原递送效率和免疫激活能力。尽管美国食品药品监督管理局(FDA)已批准多款疫苗,但由于肿瘤抗原异质性、免疫抑制微环境及递送系统优化等挑战,其治疗潜力尚未完全释放。本文系统综述了癌症疫苗的分类、新抗原发现、递送平台进展、佐剂作用机制及联合疗法的协同效应,并探讨了临床转化中的关键挑战与未来方向。
癌症疫苗的研发始于19世纪末,William B. Coley观察到细菌毒素可诱导肿瘤消退,首次揭示了免疫系统与癌症的关系。20世纪80年代,BCG疫苗被用于膀胱癌治疗,成为首个获批的治疗性癌症疫苗。2010年,Sipuleucel-T的上市标志着个性化免疫治疗的突破。近年来,基因工程技术的进步(尤其是mRNA疫苗)在胶质母细胞瘤和黑色素瘤中展现出显著潜力。例如,靶向EB病毒的mRNA疫苗WGc-043和针对黑色素瘤的mRNA-4157已在临床试验中取得积极成果。然而,肿瘤抗原异质性、免疫抑制微环境及递送效率仍是主要挑战。
 图1 治疗性癌症疫苗的免疫反应机制
图1 治疗性癌症疫苗的免疫反应机制描述:疫苗通过递送肿瘤抗原至DC,激活CTL和CD4+ Th1细胞,诱导肿瘤细胞杀伤。APC(抗原呈递细胞)通过MHC分子呈递抗原,触发T细胞受体(TCR)信号通路。
预防性与治疗性疫苗预防性疫苗
- HPV疫苗:覆盖HPV 16/18等高危亚型,降低宫颈癌、肛门癌及口咽癌发病率。临床数据显示,接种后宫颈癌前病变发生率下降60%-90%。需与常规细胞学筛查联合应用。
- HBV疫苗:通过阻断乙肝病毒感染,降低肝细胞癌风险。全球范围内接种率提升使肝癌发病率显著下降。
治疗性疫苗需满足以下关键特性:
- 高效抗原递送:优先选择肿瘤特异性新抗原(如EGFRvIII、KRAS突变),避免自身免疫毒性。
- 克服免疫抑制微环境:TME中的调节性T细胞(Treg)和髓源性抑制细胞(MDSC)可抑制DC功能,需联合佐剂(如TLR激动剂)增强DC活性。
- 持续免疫记忆:通过激活记忆T细胞,防止肿瘤复发。
肿瘤抗原的选择
共享抗原(TAAs)
TAAs在肿瘤和正常组织中均有表达,如CEA(结直肠癌)、PSA(前列腺癌)和MUC1(乳腺癌)。早期临床试验中,CEA疫苗在结直肠癌患者中诱导免疫应答,但疗效短暂。AFP肽疫苗在肝细胞癌中部分患者实现完全缓解,提示TAAs的潜力与局限性。
肿瘤特异性抗原(TSAs)
TSAs由肿瘤突变产生,如EGFRvIII(胶质母细胞瘤)、RAS突变(胰腺癌)及p53突变(多种实体瘤)。新抗原的筛选依赖于:
- 全外显子测序(WES)和RNA测序:识别体细胞突变及表达水平。
- 质谱技术(MS):精确检测免疫肽段,减少预测算法误差。
- 生物信息学工具:NetMHCpan等算法预测抗原与MHC结合亲和力。
表1 新抗原疫苗临床案例
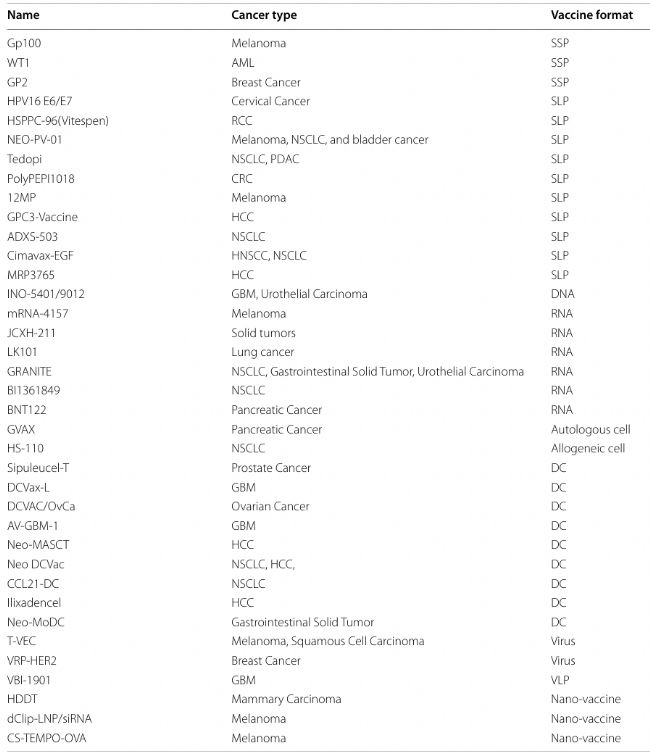
疫苗平台
1. 合成肽疫苗- 短肽疫苗(8-15氨基酸):如gp100疫苗联合高剂量IL-2,客观缓解率(ORR)达42%。但需佐剂(如Poly-ICLC)增强免疫原性。
- 长肽疫苗(20-30氨基酸):如HPV E6/E7长肽疫苗在宫颈癌中耐受性良好,诱导强效T细胞应答。
- 多价肽疫苗:NEO-PV-01联合PD-1抑制剂在黑色素瘤中ORR达35%,显著优于单药治疗。
- DNA疫苗:INO-5401编码hTERT和WT1抗原,联合PD-1抑制剂在胶质瘤中延长生存期。
- mRNA疫苗:mRNA-4157联合Pembrolizumab在黑色素瘤III期试验中降低44%复发风险。脂质纳米颗粒(LNP)递送系统提升稳定性,如BNT122在胰腺癌中激活多克隆T细胞。
- 自体肿瘤细胞疫苗:GVAX通过分泌GM-CSF募集DC,但单药疗效有限。联合化疗或免疫检查点抑制剂可增强响应。
- DC疫苗:Sipuleucel-T通过体外负载PAP抗原延长前列腺癌患者生存期(中位OS 25.8 vs 21.7个月)。DCVax-L负载肿瘤裂解物,在胶质瘤中5年生存率提升至13%。
- 溶瘤病毒:T-VEC(表达GM-CSF)在黑色素瘤中客观缓解率25.2%,中位OS 41.1个月。
- 病毒样颗粒(VLP):VBI-1901靶向CMV抗原,在复发性胶质瘤中中位OS达12.9个月。
- 脂质体/介孔二氧化硅:增强抗原递送至淋巴结,激活DC和CTL。如dClip-LNP/siRNA纳米疫苗通过沉默TIM-3增强抗肿瘤免疫。
- 自组装纳米结构:CS-TEMPO-OVA纳米疫苗联合PD-1抑制剂抑制黑色素瘤转移。
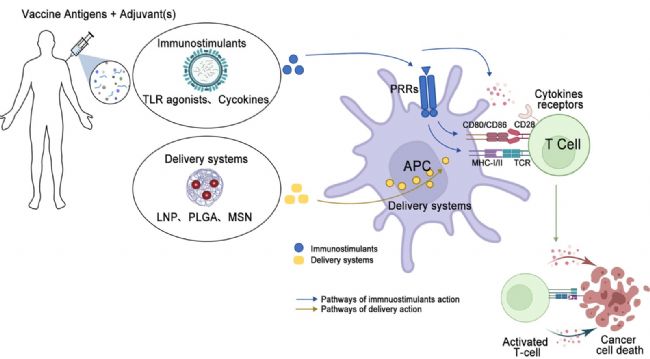 图2 纳米疫苗作用机制
图2 纳米疫苗作用机制描述:纳米载体共递送抗原和佐剂至淋巴结,促进DC成熟及T细胞活化。
佐剂的作用机制免疫刺激剂
- TLR激动剂:
TLR4激动剂(MPL)激活NF-κB通路,促进Th1极化。
- 细胞因子:IL-12和GM-CSF增强T细胞增殖,但需平衡疗效与毒性(如IL-2引发毛细血管渗漏综合征)。
- 脂质纳米颗粒(LNP):保护mRNA免受降解,如Moderna的mRNA-5671靶向KRAS突变。
- 可降解聚合物(PLGA):控释抗原,延长免疫应答。
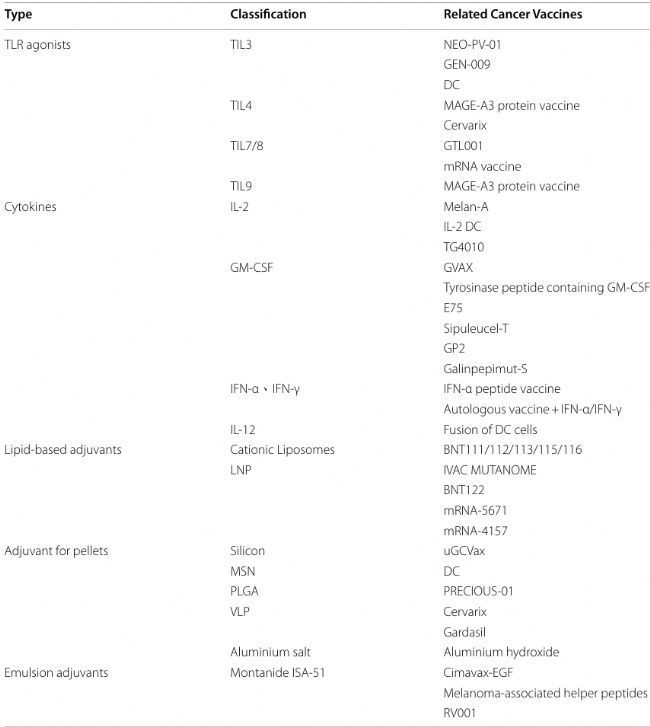
表2 佐剂分类及代表疫苗
联合疗法
1. 化疗联合化疗诱导免疫原性细胞死亡,释放肿瘤抗原。
案例:SurVaxM(靶向Survivin)联合替莫唑胺在胶质母细胞瘤中延长无进展生存期(PFS 11.4个月)。
2. 放疗联合
放疗增强肿瘤抗原释放并改变TME。
案例:PSA靶向疫苗联合放疗在前列腺癌中显著提升抗原特异性T细胞数量。
3. 免疫检查点抑制剂(ICI)联合
疫苗逆转T细胞耗竭,ICI阻断PD-1/PD-L1通路。
案例:mRNA-4157联合Pembrolizumab在黑色素瘤中ORR达50%,降低复发风险44%。
4. CAR-T联合
疫苗增强CAR-T持久性与肿瘤浸润。
案例:CLDN6 mRNA疫苗联合CAR-T在实体瘤中实现33%客观缓解率。
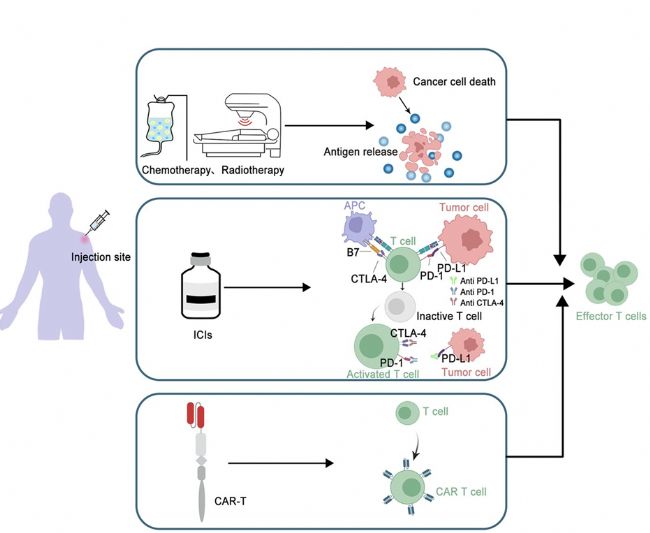 图3 联合疗法机制示意图
图3 联合疗法机制示意图描述:疫苗与化疗、放疗、ICI或CAR-T协同,通过多通路激活抗肿瘤免疫。
临床挑战1、抗原筛选与个性化制备:新抗原预测需结合基因组学与免疫肽组学,成本高且周期长。
2、动物模型局限性:人源化小鼠难以完全模拟人类免疫系统,需开发类器官或芯片替代模型。
3、不良反应管理:
- 常见:注射部位反应、发热、疲劳。
- 严重:细胞因子释放综合征(CRS)、自身免疫性毒性。
- 耐药机制:肿瘤抗原丢失或MHC下调可导致免疫逃逸。
结论与展望
癌症疫苗通过多平台创新与联合策略展现出变革性潜力。未来方向包括:
- 精准新抗原筛选:结合AI优化预测算法,降低成本。
- 新型递送系统:开发靶向淋巴结或穿透血脑屏障的纳米载体。
- 克服免疫抑制:联合TME调控剂(如TGF-β抑制剂)或表观遗传药物。
- 临床转化加速:利用器官芯片替代部分动物试验,缩短研发周期。
随着mRNA技术和个性化医疗的突破,癌症疫苗有望成为“治愈性疗法”的重要组成部分,为实体瘤和血液肿瘤患者带来长期生存希望。





