多组学分析研究胃癌腹膜转移的分子机制和TME特征
图形摘要
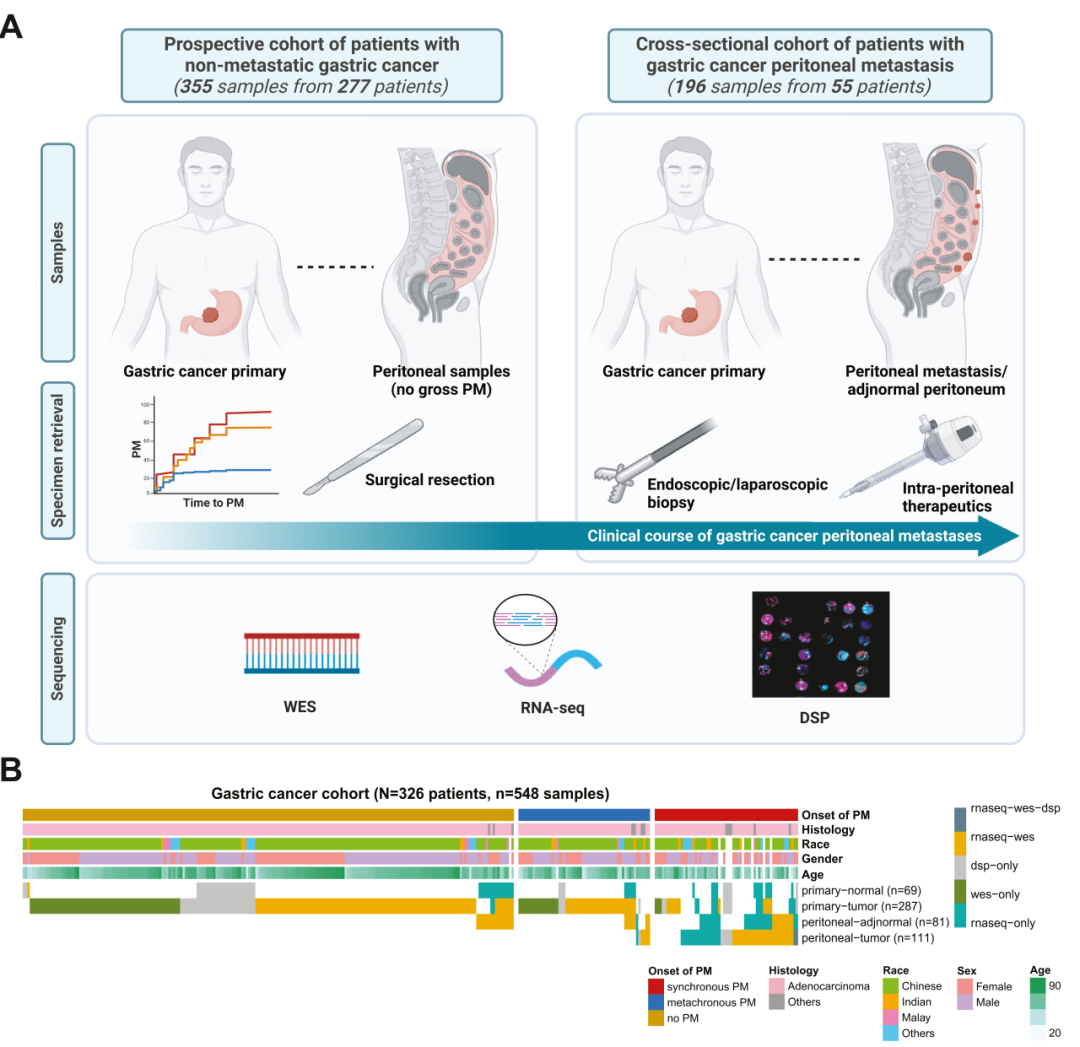
样本信息
文章主要结果
01 胃癌原发肿瘤(PT)中推动腹膜转移(PM)的分子和免疫特征
对209个GCPT样本进行了WES分析,对124个PT样本进行了RNA 测序,这些样本在 PT 切除术后均有出现腹膜转移。研究发现,PT中如ELF3、CDH1和PIGR等驱动基因的突变与腹膜转移显著相关。同时,PM风险增加与高度的基质浸润、上皮-间质转化(EMT)、以及IL2-STAT5和IFN-γ等炎症相关通路的富集相关。免疫分析表明,与腹膜转移相关的肿瘤微环境特征包括M2型巨噬细胞和成纤维细胞的浸润。
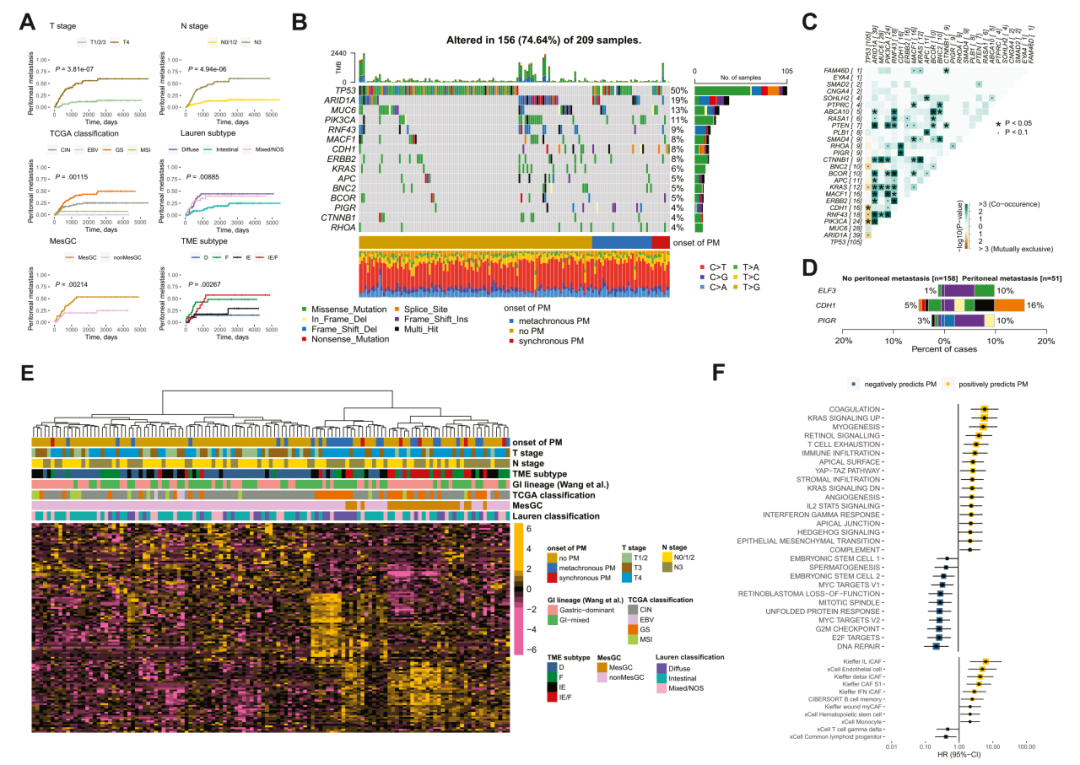
驱动胃癌腹膜转移的致癌基因和通路
02 PT与PM中肿瘤微环境的空间分布和免疫组成变化
对来自39名患者的67个样本(37个PT-PM和30个原发性邻近正常组织)进行了DSP数字空间转录组分析。研究发现出现腹膜复发的患者,其肿瘤区域的基因表达模式与基质区域更加相似,同时伴随上皮-间质转化(EMT)和基质浸润通路的增强。此外,肿瘤区中与肿瘤相关的M2型巨噬细胞和促炎症的成纤维细胞等免疫细胞显著富集,而自然杀伤细胞和调节性T细胞在基质区的比例较高。这些结果表明,肿瘤与基质之间的相互作用和肿瘤免疫细胞的重新分布可能在腹膜复发中发挥重要作用。
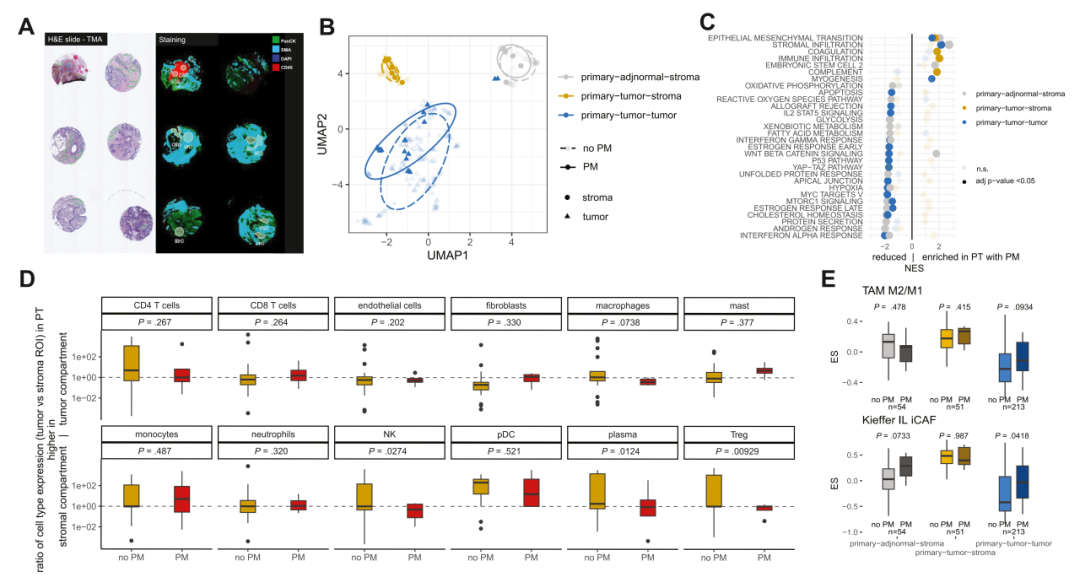
与腹膜复发相关的空间微环境变化
03 胃癌腹膜转移的分子进化、免疫重塑及生态位重编程
通过WTS和伪时间分析,揭示了胃癌PT向PM演进的分子轨迹。研究表明,PM样本表现出更高的EMT、血管生成、YAP-TAZ通路活性,以及促炎症细胞的显著富集。此外,PM的转录组特征与肝转移截然不同,突出腹膜转移的特异机制。通过分析,比较了原发肿瘤和腹膜转移灶中潜在的治疗靶点和免疫微环境,发现PM中CLDN18.2和FGFR2b等关键治疗靶点的表达显著降低,而HAVCR2等促炎症和免疫逃逸相关基因的表达升高。这进一步表明PM可能对现有疗法反应较差,同时也提示了新的治疗靶点。结合人体组织样本分析和人源化小鼠模型发现,早期胃癌中可能出现前转移生态位(PMN)的重塑,表现为炎症信号增强和肿瘤友好型免疫环境的形成。小鼠模型验证了这些生态位改变在促进肿瘤细胞腹膜种植和扩散中的关键作用。
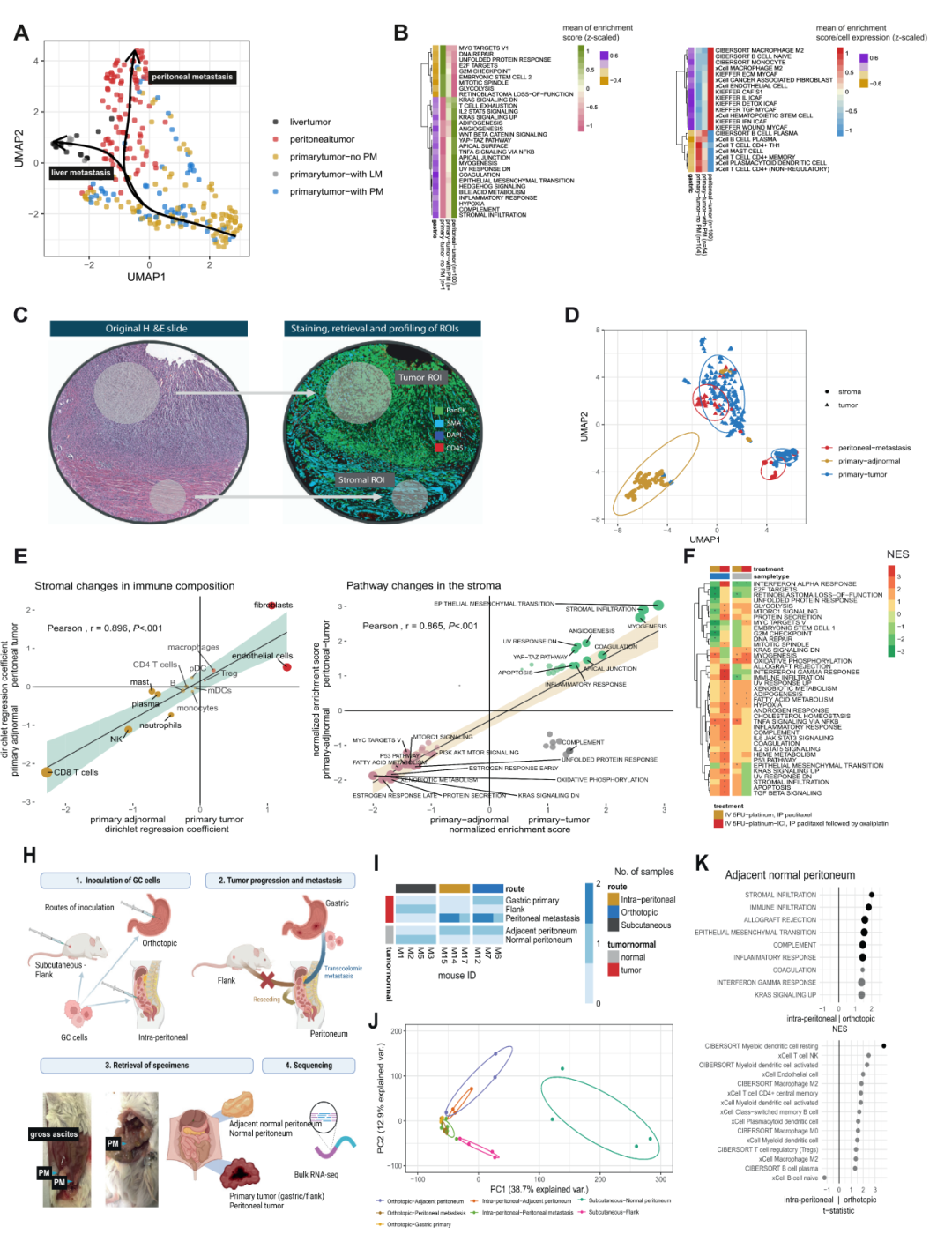
胃癌腹膜转移的分子进化、免疫重塑及生态位重编程
文章总结
这篇文章通过多组学分析深入探讨了胃癌腹膜转移的分子机制和TME特征。研究结合了WES、WTS和DSP,分析了326名胃癌患者的548份样本。研究发现,胃癌腹膜转移与特定的基因突变和免疫微环境特征密切相关。此外,研究揭示了腹膜转移过程中微环境的重编程现象,早期胃癌患者甚至在没有临床腹膜转移的情况下也可能出现腹膜前转移生态位的变化。空间转录组学分析显示,腹膜转移与其他转移类型(如肝转移)在分子特征和免疫组成上存在明显差异,提示腹膜转移具有独特的生物学机制。最后,文章通过人源化小鼠模型验证了腹膜微环境的重编程对转移的促进作用,进一步加强了研究结果的可靠性。这些发现为胃癌腹膜转移的早期诊断、个性化治疗和靶向治疗提供了新的理论依据,并为未来的临床试验设计和免疫疗法的开发提供了重要指导。





