细胞培养过程中,台盼蓝染色和AOPI染色分析细胞活率的正确操作方式
在细胞培养过程中,了解细胞的活率对于评估细胞健康状态、优化培养条件以及进行药物筛选等实验至关重要。细胞活率的分析方法主要包括镜检法(如血球计数板)、图像分析法、电阻抗法、流式细胞术等,它们各自具有独特的优势和局限性。最常用的方法是图像分析法,图像分析法可以自动拍照和数据分析统计,适应性强,适用于几乎所有类型细胞的检测,图像分析中区别细胞死活的方式主要为台盼蓝染色和AOPI染色。
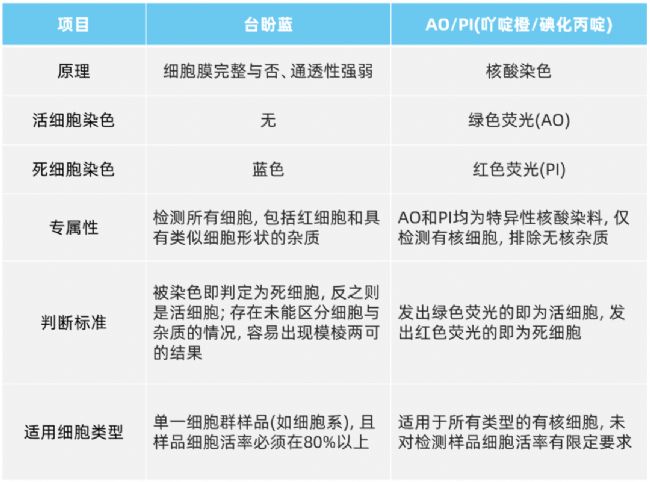
染色原理:台盼蓝染色和AOPI染色
台盼蓝染色原理:正常的活细胞,胞膜结构完整,能够排斥台盼蓝,使之不能够进入胞内;而丧失活性或细胞膜不完整的细胞,胞膜的通透性增加,可被台盼蓝染成蓝色,通常认为细胞膜完整性丧失,即可认为细胞已经死亡。因此,被染色的细胞为死细胞,没有被染色的为活细胞。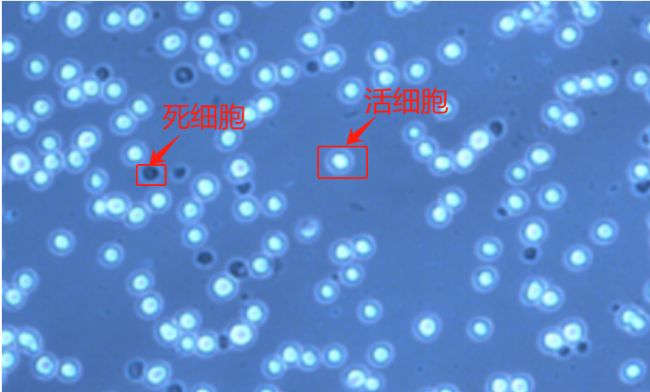
影响因素:结果依赖于实验操作规范

自动化解决方案:消除人为操作风险

光学系统:双荧光+明场适应各种染色方式
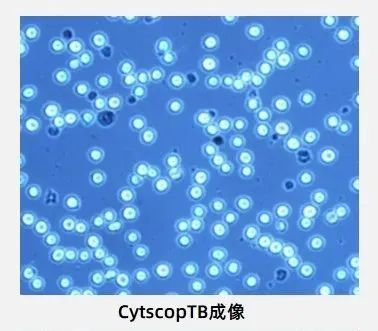
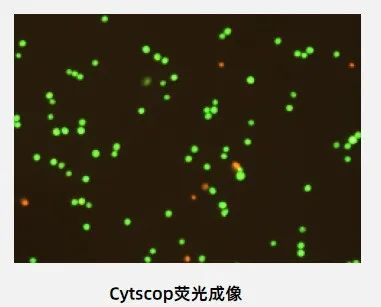
CytScop®的AI模型能够更科学地识别细胞凋亡/团簇团聚等复杂情况;模型运行时,不再需要人为设置各种参数阈值如直径、亮度、圆度、系数等,对不同的细胞类型/生物工艺具有良好的可拓展性与更准确的泛化能力,使得分析结果更加准确。

染色原理:台盼蓝染色和AOPI染色
台盼蓝染色原理:正常的活细胞,胞膜结构完整,能够排斥台盼蓝,使之不能够进入胞内;而丧失活性或细胞膜不完整的细胞,胞膜的通透性增加,可被台盼蓝染成蓝色,通常认为细胞膜完整性丧失,即可认为细胞已经死亡。因此,被染色的细胞为死细胞,没有被染色的为活细胞。

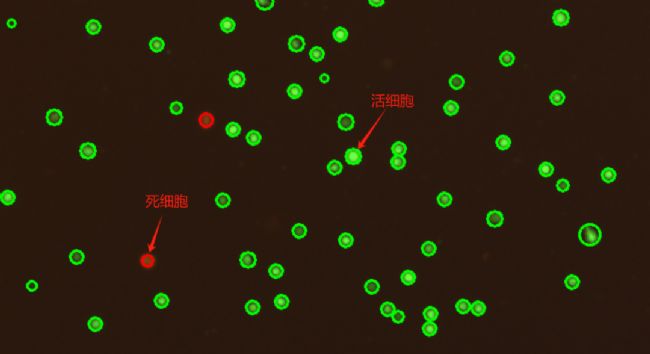
AOPI染色原理:AOPI试剂由AO(Acridine Orange,吖啶橙)和PI(Propidium iodide,碘化丙啶)组成。其中,AO是一种异染性荧光阳离子染料,可渗透细胞膜,并嵌入所有细胞(活细胞和死细胞)的细胞核,检测到绿色荧光。PI不能通过完整的细胞膜,只能进入死细胞的细胞膜,并嵌入死细胞的细胞核,检测到红色荧光。当AO、PI试剂均存在于细胞中,在合适的染料配比下,染料间会发生荧光共振能量转移,致活细胞被激发出绿色荧光,死细胞被激发出红色荧光。


影响因素:结果依赖于实验操作规范
AOPI染色和台盼蓝染色作为细胞实验中评估细胞活力和数量的关键方法,在传统的图像分析法中,其结果是否准确高度依赖于实验人员是否严格遵守操作规范。在AOPI中,染色工作液的配制、细胞样本的处理及检测时的操作细节,任何一环的人为疏忽都可能影响细胞染色效果和最终的分析结果。同样,在台盼蓝染色过程中,细胞悬液的制备、染料的配制与染色时间以及细胞计数的准确性,均受到人为因素的影响,进而影响细胞活力的评估。

另外,台盼蓝染料具有一定毒性,操作时需严格佩戴手套和口罩,做好防护措施,避免接触皮肤和吸入气体,对健康产生不利影响。
自动化解决方案:消除人为操作风险
细胞样品制备实现自动染色和混匀:浚真生命科学自主研发的微流控芯片,将台盼蓝/AOPI染料试剂包埋于微米级的系统结构中,细胞样品从微流控芯片进样口进入后,将在流向芯片检测区的过程中实现自动染色和混匀,不再需要人为进行样品染色及混匀制备,消除人为操作风险,不仅为实验人员减轻工作量,避免杂质干扰,还为检测结果的准确性和精确性提供有力保障。

光学系统:双荧光+明场适应各种染色方式
双荧光+明场集成光学系统:浚真生命科学研发的CytScop®系列智能细胞计数仪搭载“双荧光+明场”的宽场大视野光学系统,结合高分辨率物镜及自动对焦计数,在捕获更多细胞样本的同时,保持高对比度及清晰度,可实现自动调整焦距和曝光度,无需人为干预,在明场下有良好的细胞形态细节表现能力,暗场中能够收集更多荧光信号,识别细胞更准确。“双荧光+明场”集成式光学系统设计,方便用户根据实验需求自如选择细胞染色方法,轻松获取准确的分析数据。


CytScop®的AI模型能够更科学地识别细胞凋亡/团簇团聚等复杂情况;模型运行时,不再需要人为设置各种参数阈值如直径、亮度、圆度、系数等,对不同的细胞类型/生物工艺具有良好的可拓展性与更准确的泛化能力,使得分析结果更加准确。






