组织芯片+DSP空间组学揭示小细胞肺癌肿瘤内分子特征和亚型异质性
文章题目:Spatial Transcriptome-Wide Profiling of Small Cell Lung Cancer Reveals Intra-Tumoral Molecular and Subtype Heterogeneity
中文题目:空间组学技术揭示小细胞肺癌肿瘤内分子特征和亚型异质性
发表时间:2024.06.19
期刊名称:Advanced Science
影响因子:15.1
实验平台:DSP空间转录组学
DOI:10.1002/advs.202402716
一、研究背景
小细胞肺癌(SCLC)因其快速增长、早期转移及对治疗的抵抗性和复发性而著称,患者的五年总体生存率不足7%。尽管近年来包括免疫治疗和化疗组合在内的治疗方法取得了一些进展,但在提高生存率方面收效甚微。传统的“一刀切”治疗策略未能充分考虑肿瘤内及肿瘤间的异质性,这种异质性显著影响患者的治疗反应和预后。为了填补这一知识空白,本研究利用DSP技术,对25名SCLC患者进行空间转录组分析,揭示了肿瘤内部的区域异质性。研究发现,不同空间局部的组织区域具有独特的分子特征、生物功能、免疫特征和分子亚型。此外,研究还建立了与患者生存和治疗反应相关的转录组内异质性(ITH)特征,并通过多中心患者队列验证了这些特征的预后价值。
二、技术路线
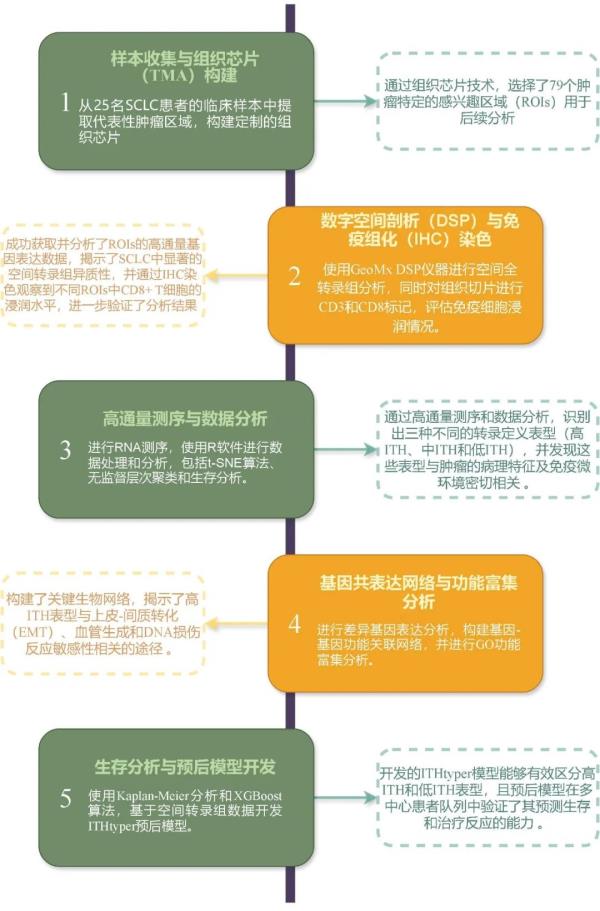
三、研究结果
1. 数字空间转录组分析在SCLC中的应用
通过DSP技术,研究团队对来自25名SCLC患者的79个肿瘤特定区域(ROIs)进行了高分辨率的基因表达分析。分析显示,SCLC肿瘤内存在显著的转录异质性,主要体现在不同区域的基因表达谱、分子特征和生物学功能上。具体而言,不同肿瘤区域在免疫细胞浸润、上皮-间质转化(EMT)和血管生成等生物学过程中的基因表达存在显著差异。这些发现不仅揭示了SCLC肿瘤内复杂的生物学特性,还为理解肿瘤异质性如何影响疾病进展和治疗反应提供了新的视角。利用DSP技术,研究团队能够对不同区域进行精细的分子分型,确定了具有独特分子特征的高、中、低ITH表型。这些表型的识别对于进一步理解SCLC的病理特征和开发个性化治疗策略具有重要意义。
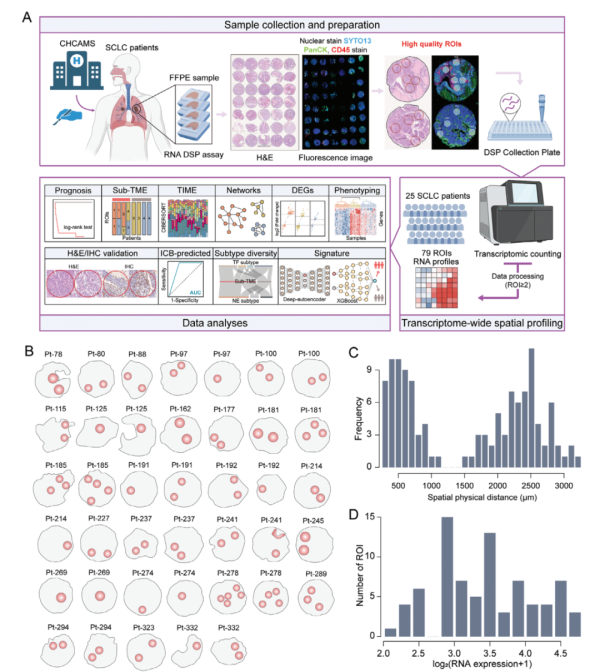
Fig1. SCLCs的转录组空间图谱研究框架
2. ITH表型与肿瘤微环境的免疫特征
研究表明,不同的肿瘤内异质性(ITH)表型在免疫细胞浸润方面表现突出。通过对SCLC患者肿瘤样本进行详细分析,发现中等异质性(m-ITH)表型在肿瘤微环境中具有显著增多的CD8+ T细胞。这些细胞在免疫反应中扮演重要角色,能够直接杀伤肿瘤细胞。具体而言,m-ITH表型中的CD8+ T细胞不仅数量显著增加,而且其功能也显著增强。这些T细胞的抗原呈递能力和免疫检查点分子的表达水平较高,表明这些区域具有更高的免疫活性。例如,研究通过免疫组化(IHC)染色观察到,m-ITH表型区域中CD8+ T细胞的浸润显著高于其他表型。此外,基因表达分析显示,这些区域中与抗原呈递相关的分子(如MHC-I类分子)和免疫检查点分子(如PD-1和CTLA-4)的表达水平显著升高。这种免疫特征的差异不仅反映了不同ITH表型的生物学差异,也提示了这些表型在肿瘤免疫逃逸和治疗反应中的潜在作用。高水平的CD8+ T细胞浸润和增强的免疫功能表明,m-ITH表型可能对免疫治疗更加敏感。因此,这些发现对开发基于肿瘤异质性的个性化治疗策略具有重要意义。
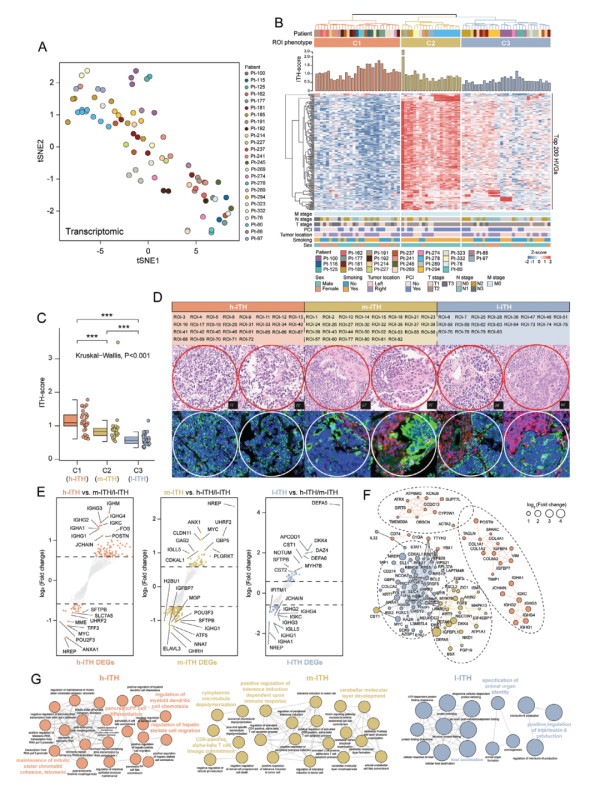
Fig2. DSP鉴定的与肿瘤内ROI相关的不同表达模式
3. ITH与患者生存和治疗结果的关系
研究通过将ITH表型映射到患者层面,揭示了肿瘤微环境复杂度(TME)与患者生存和治疗结果之间的显著关系。将ROIs按照其ITH表型分为高复杂度TME(HCs-TME)和低复杂度TME(LCs-TME)两组,并比较了这两组患者的生存率和无病生存率。结果显示,LCs-TME患者的总体生存率(OS)和无病生存率(DFS)显著优于HCs-TME患者。在Kaplan-Meier生存分析中,LCs-TME组的患者表现出更长的生存时间和较低的复发率。具体来说,LCs-TME组患者的五年生存率明显高于HCs-TME组,且在无病生存时间上也具有显著优势。此外,研究还发现LCs-TME患者在治疗反应方面表现出更好的效果。LCs-TME组患者对治疗的响应更好,尤其是在接受免疫治疗和化疗的患者中,LCs-TME组表现出更高的完全缓解率和部分缓解率。这表明,肿瘤微环境的复杂度不仅影响患者的生存预后,还显著影响其对治疗的响应。这些发现提示,肿瘤内异质性及其导致的微环境复杂度在SCLC的临床结局中扮演了重要角色。高复杂度TME可能促进了肿瘤的侵袭性和耐药性,从而导致较差的生存和治疗结果。而低复杂度TME则可能提供了更有利的条件,促进了更有效的免疫响应和治疗效果。因此,基于ITH表型的患者分类有望在未来的个性化治疗策略中发挥重要作用,帮助临床医生更精准地制定治疗计划,提高患者的生存率和生活质量。
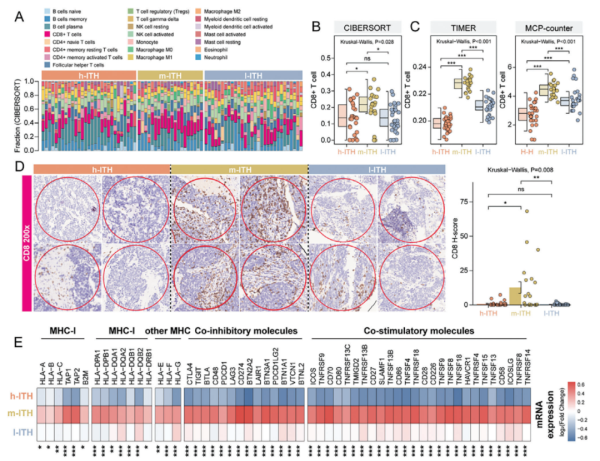
Fig3. 肿瘤内空间微环境中的免疫特征
4. ITH揭示肿瘤分子亚型的异质性
研究发现,不同的ITH表型在肿瘤-基质模式和癌细胞形态方面存在显著差异。高ITH肿瘤表现出更高的肿瘤纯度,这些区域的肿瘤细胞占据主导地位,通常呈现出典型的裸核形态。这一形态特征常与高度侵袭性和快速增殖相关。相反,中低ITH表型的肿瘤展示了更复杂的肿瘤-基质模式。这些区域中,研究发现了显著的纤维化基质和大量的淋巴细胞浸润。纤维化基质由大量的纤维母细胞和胶原蛋白组成,反映了肿瘤微环境中持续的免疫反应和组织重塑过程。中低ITH表型肿瘤中的淋巴细胞浸润主要包括T细胞和B细胞,提示这些肿瘤区域存在较强的免疫反应。通过这些分析,研究揭示了SCLC肿瘤内存在显著的分子亚型异质性,不同ITH表型在肿瘤细胞和基质成分上的差异为理解肿瘤的生物学特性提供了新的视角。这些发现不仅有助于解释肿瘤的异质性对疾病进展和治疗反应的影响,还为未来的肿瘤分类和个性化治疗策略提供了重要的基础。总之,ITH分析揭示了SCLC中不同分子亚型的显著异质性,这些异质性反映在肿瘤-基质模式和癌细胞形态上,这为深入理解肿瘤生物学及其临床意义提供了宝贵的见解。
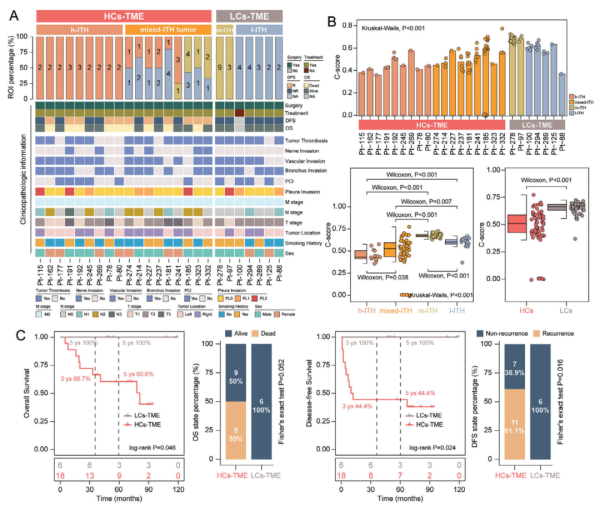
Fig4. 肿瘤内空间异质性与患者的生存率和治疗结果相关
5. ITH相关的预后模型开发
研究团队开发了名为ITHtyper的预后模型,该模型基于ITH的特征,能够有效区分高ITH和低ITH表型。ITHtyper模型利用空间转录组数据,通过先进的机器学习算法,如XGBoost,进行训练和验证。这一模型在多中心患者队列中进行了严格的验证,结果显示其在预测患者生存率和治疗反应方面表现出色。ITHtyper模型通过识别关键的基因表达模式,能够准确预测患者的预后。高ITH表型通常与较差的生存率和较低的治疗反应相关,而低ITH表型则表现出更好的生存结果和更高的治疗响应率。在多中心队列验证中,包括多个独立的患者数据集,ITHtyper模型显示出高度的预测准确性和稳健性,进一步确认了其临床应用价值。此外,ITHtyper在预测免疫治疗反应方面也表现出优异的性能。研究发现,低ITH表型的患者对免疫检查点抑制剂(如PD-1和CTLA-4)等免疫治疗具有更好的反应。这一发现具有重要的临床意义,因为它能够帮助临床医生根据患者的ITH表型选择最合适的治疗方案,提高治疗效果。总的来说,ITHtyper模型的开发和验证为个性化治疗提供了强有力的工具,通过精确识别患者的ITH表型,可以更好地预测治疗效果,制定最优的治疗策略,提高患者的生存率和生活质量。
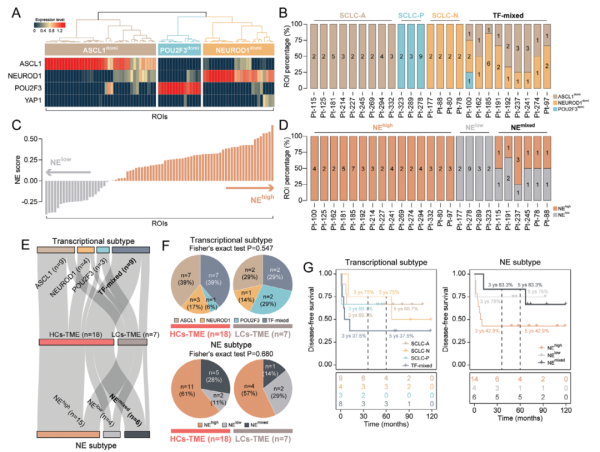
Fig5. SCLC肿瘤内空间异质性与常规分子分类的相关性
四、主要结论
通过DSP技术对25名SCLC患者的79个ROIs进行全转录组分析,揭示了SCLC中显著的ITH。研究发现,不同的ITH表型在基因表达、肿瘤-基质模式和免疫细胞浸润方面存在显著差异。高ITH肿瘤表现出更高的肿瘤纯度和典型的裸核形态,而中低ITH肿瘤则显示出更明显的纤维化基质和淋巴细胞浸润。通过这些数据,研究团队开发了名为ITHtyper的预后模型,该模型能够有效区分高ITH和低ITH表型,并在多中心患者队列中验证了其预测生存率和治疗反应的能力。特别是,ITHtyper在预测免疫治疗反应方面表现优异,低ITH表型患者对免疫检查点抑制剂(如PD-1和CTLA-4)的反应更好。总的来说,这些发现为理解SCLC的生物学特性和临床行为提供了新的见解,并为个性化治疗策略的开发提供了强有力的工具。





