单细胞分析助力绘制人类癌症中肿瘤浸润B细胞的蓝图
近日,复旦大学附属中山医院樊嘉院士、高强教授、中国科学院上海免疫与感染研究所张晓明研究员、浙江大学基础医学院郭国骥教授团队合作,在《Science》 期刊发表了题为“A blueprint for tumor-infiltrating B cells across human cancers ”的研究论文。该研究结合单细胞转录组、 单细胞BCR和单细胞ATAC的多组学数据,系统性刻画了肿瘤浸润性B细胞的异质性、动态分化和表观调控机制。创新地揭示了肿瘤微环境中广泛存在的EF应答的癌种偏好性、空间定位特征、临床意义及潜在的诱导调控机制。该研究由上海生物芯片有限公司(生物芯片上海国家工程研究中心)提供部分支持。
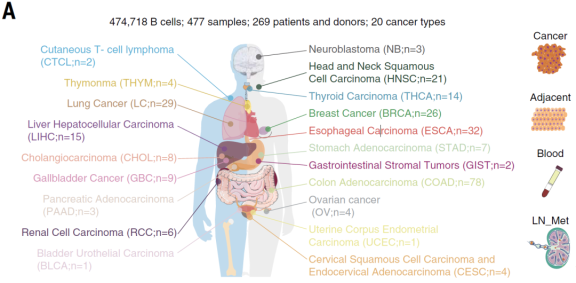
在肿瘤免疫过程中,肿瘤浸润性B细胞在肿瘤免疫过程中扮演着重要的角色。这些B细胞表现出多种功能,主要是通过它们分化为浆细胞产生抗体的能力,但在不同的癌症类型中,它们在时空上存在差异。解剖不同癌症类型中B细胞的丰度和分化状态有望改善免疫治疗反应。为了构建全面的肿瘤B细胞景观,该团队研究人员对 20 种癌症类型(477个样本,269例患者)的 B 细胞进行了全面的单细胞多组学分析,将肿瘤浸润 B 细胞反应分为生发中心 (GC) 样和滤泡外(EF),具有癌症类型偏好。结果发现,EF B细胞反应与免疫抑制性肿瘤微环境(TME)和不良预后有关。相反,GC样B细胞反应与抗肿瘤免疫和良好的结果有关。
01 文章详情
文章题目:A blueprint for tumor-infiltrating B cells across human cancers
中文题目:人类癌症中肿瘤浸润B细胞的蓝图
发表时间:2024.05
期刊名称:Science
影响因子:56.9
实验技术:scRNA-seq、scBCR-seq、snATAC-seq、mIHC、代谢组、转录组、Bulk ATAC
DOI:10.1126/science.adj4857
02 文章整体思路
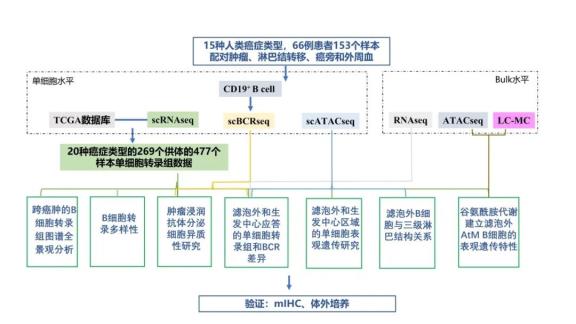
03 研究内容
1、跨越人类癌症的单个B细胞转录组蓝图
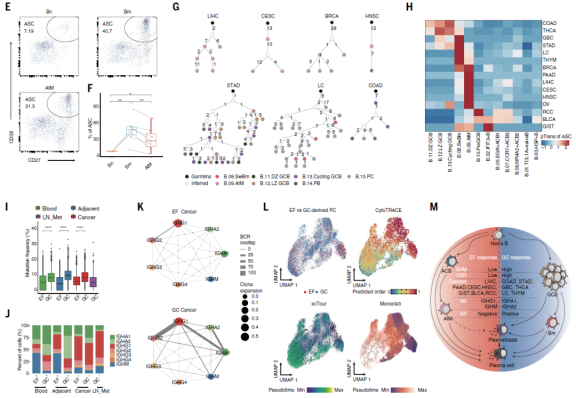
B细胞浸润在不同类型的人类癌症中差异很大,文章首先基于癌症基因组图谱(TCGA) Pan-Cancer数据集(n = 8863,31种癌症) 评估了多种肿瘤的B细胞浸润特征。随后进一步选择具有高和中等肿瘤内B细胞评分的癌症类型进行采样,从15种人类癌症类型的66例患者的153个样本中富集分选CD19+ B细胞,包括配对的肿瘤、淋巴结转移(LN_Mets)、邻近的正常组织和外周血,进行单细胞RNA测序(scRNA-seq)和单细胞B细胞受体测序(scBCR-seq)。结合数据库数据最终建立了来自20种癌症类型的269个供体的477个样本的单细胞转录图谱(图1A)。共获得了474,718个B细胞转录组,其中69.24%为本研究中新生成的。单细胞图谱为B细胞研究创建了一个泛癌蓝图(http://pancancer.cn/B/)。
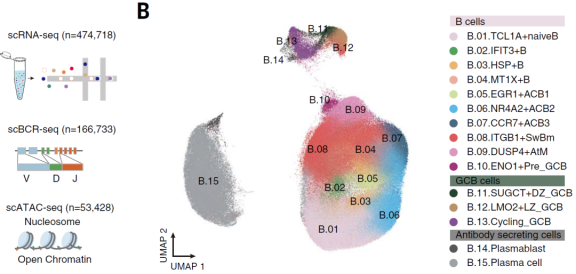
2、B细胞的转录多样性
非监督降维聚类分析确定了15种不同的B细胞亚群,这些亚群在不同的癌症类型均有存在,并表现出不同的组织和癌症类型偏好(图1B)。其中,鉴定出代表不同B细胞成熟阶段的典型B细胞亚群,包括1个naïve B细胞群, 3个activated B细胞群((ACBs;CD69和CD83)), 1个memory B细胞群, 3个GC B细胞群(LMO2+Light Zone (LZ), CXCR4+Dark Zone (DZ)和MKI67+cycling), 2个ASCs(TXNDC5+PBs和MZB1+ PCs)(图1C)。除此之外又鉴定出了4种新的亚群(图C):(1)干扰素刺激基因阳性naïve B细胞亚群(B_02),其高度表达IFIT3、IFI44L和ISG15,与损伤相关;(2)应激B细胞(B_03),在肿瘤中占主导地位,位于TLSs中心,高表达缺氧相关基因;(3)GC前体B细胞(B_10),在淋巴结和肿瘤中富集,一种过渡态B细胞;(4)AtM B细胞亚群(B_09),该亚群广泛存在于TME中,高度表达应激相关基因、干扰素诱导基因和激活相关基因。新鉴定出的4种B细胞亚群表现出了各自独特的功能特征。
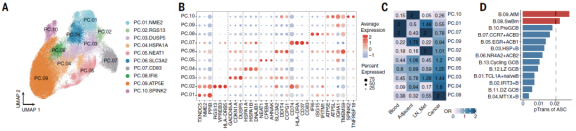
3、肿瘤浸润性抗体分泌细胞(ASCs)的异质性
ASCs是通过产生抗体来执行效应功能的终末分化B细胞。本次高分辨图谱显示肿瘤浸润的ASCs在组织分布、癌症类型偏好、BCR库和转录组谱方面表现出多方面的多样性。
结合scBCR结果显示ASCs的比例变化很大,肿瘤浸润的ASCs比邻近正常组织和血液中的ASCs具有更高的多样性(P < 0.01),而非ASCs的多样性在淋巴结中最高。15个B细胞亚群中,2个ASC亚群表现出最高的基因表达异质性。对ASC进行非监督降维聚类分析发现10个不同的PC亚簇具有特定的基因特征和组织分布(图2A和2B)。这些发现可能有助于解释PC在患者预后中的有争议的作用,这可能归因于不同PC亚群和癌症类型的可变性。总的来说,这些数据表明不同癌症类型对ASCs的浸润有相当大的影响,也意味着ASCs的B细胞起源不同。
4、滤泡外(EF)路径和生发中心(GC)路径被癌症劫持
之前有研究表明源自GC或EF应答的B细胞通路在自身免疫性疾病和慢性感染中都被观察到,但肿瘤生态系统影响不同B细胞进化轨迹的潜力尚未得到彻底探索。由于基于PC标记的高表达,传统的基于转录组的轨迹分析可能无法准确反映真实的分化状态。为了解决这个问题,使用BCR克隆共享策略和无监督聚类来识别ASCs的祖细胞,并通过RNA-seq和TCR跟踪的单T细胞分析配对过渡指数(pTrans)、Jaccard指数和体细胞超突变(SHM)来进行追踪,表明BCR免疫组库是追踪ASCs谱系的可靠分子标签。结果发现AtM和Bm细胞是与ASCs克隆共享的两个原代B细胞,这表明ASCs可能起源于典型的GC和替代的滤泡外通路途径。GC和EF反应在不同的肿瘤中具有对应的明显反应特征。以上表明两个进化路径(GC和EF)被不同的癌症生态系统劫持。
文章进一步分析了BCR库,并匹配了这两种进化路径的转录特征。为了比较EF和GC来源的ASCs分化的早期和晚期,使用了cytoTRACE、scTour和Monocle3三种方法来推断分化状态,结果进一步支持了EF衍生ASCs的早期反应与GC衍生ASCs的延后反应形成对比的观点。总的来说,不同的癌症生态系统劫持了两条进化路径(EF和GC),并揭示了EF和GC衍生的ASCs之间BCR谱和转录特征的差异,表明了它们在抗肿瘤反应中的独特作用(图2M)。
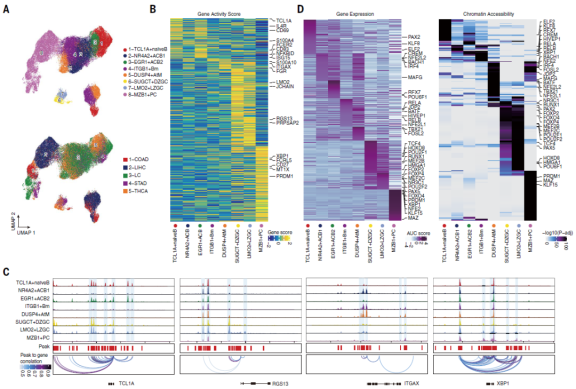
5、表观遗传学上调控元件在调控滤泡外和生发中心的平衡
转录调控是决定和维持B细胞身份的基础。文章应用配对scRNA-seq和scATAC-seq 来表征TIBs的表观基因组学,并获得了来自5种癌症类型的9名患者的53,428个TIBs的染色质可及性图谱。在scRNA-seq和scATAC-seq中得到的B细胞亚型及亚型的marker具有高度一致性(图3B)。随着B细胞分化,这些TF活性在EF和GC 肿瘤之间有所不同。随后评估了TF偏差评分,以确定EF和GC肿瘤之间调节因子的差异。
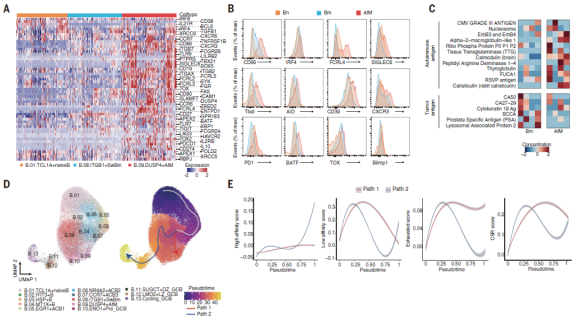
6、滤泡外的AtM B细胞具有耗竭表型,独立于生发中心发育
AtM B细胞作为EF路径的主要祖细胞在TME中起关键作用,研究人员全面研究了它们的表型和功能。AtM B细胞高度表达BCR信号(SYK)、免疫调节和激活基因(TLR7/9、CD80、CD86和CD72)。流式细胞术进一步证实了这些独特的表型(图4B)。这些数据共同证明了滤泡外AtM B细胞的独特免疫表型和分子特征。同时,在Bm中观察到体细胞高度突变(SHM),但在AtM B细胞中观察到低或中等水平。总的来说数据表明,耗竭的AtM B细胞表现出抗体分泌能力受损、旁观者激活和弱肿瘤反应性,独立于生发中心发育。
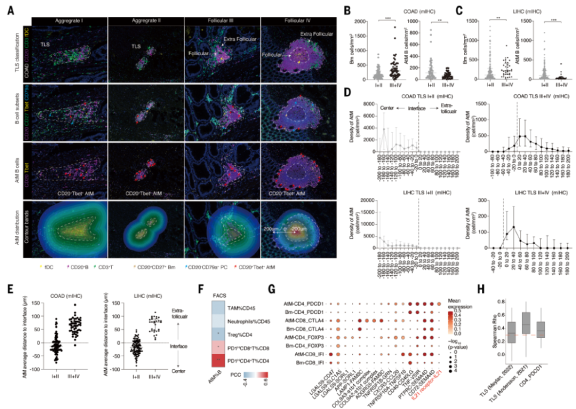
7、滤泡外B细胞空间分布于未成熟的三级淋巴结构中
TLSs通常由不同大小和细胞组成的B细胞形成。TLSs和TIBs,特别是AtM B细胞之间的空间结构和关系尚不清楚。因此着重对这一部分做了探讨。根据T细胞和B细胞的数量以及fDC染色将T细胞和B细胞分为4个阶段(图5A)。在COAD和LIHC中,AtM B细胞在未成熟TLSs中显著富集,而Bm细胞主要位于成熟TLSs中(图5B和5C)。不同TLSs阶段的ASC密度没有差异。AtM B细胞主要位于未成熟TLSs的中心,这与早期EF反应和TLS形成的促进一致(图5D和5E)。随着TLS成熟,AtM B细胞迁移到外围,而naïve B细胞始终位于TLSs的中心。这些数据证实了AtM B细胞不依赖GC的发育,也表明TLS成熟阶段驱动EF和GC 癌症中不同的B细胞分化。
8、谷氨酰胺代谢建立了滤泡外AtM B细胞的表观遗传特性
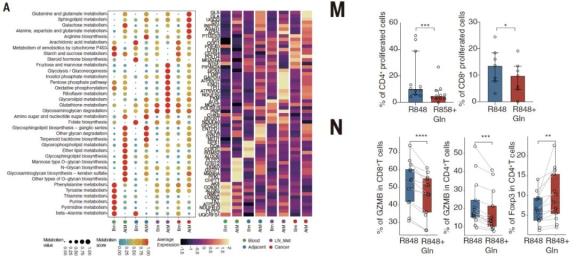
接下来,团队研究了哪些因素在机制上驱动了TME对EF和GC路径的主要反应。B细胞的通路分析显示,不同人类癌症类型的代谢途径存在很大差异,这表明B细胞身份可能受到代谢调节。鉴于谷氨酰胺在TME中的重要作用和大量丰度,在队列中研究了谷氨酰胺与B细胞免疫表型之间的关系。通过质谱分析表明,EF反应优势型癌症(LIHC、CESC和RCC)的谷氨酰胺含量明显高于GC反应优势型癌症。在LIHC中,肿瘤中的谷氨酰胺水平明显高于邻近正常组织,而COAD和STAD这两种GC优势型癌症的谷氨酰胺水平低于邻近正常组织。因此谷氨酰胺代谢可能在TME中启动EF反应中起潜在作用。进一步证明了谷氨酰胺衍生的代谢物α-酮戊二酸(α-KG)可以增加AtM B细胞相关转录因子T-bet和BATF的表达并促进其分化,同时激活哺乳动物雷帕霉素复合物1(mTORC1)信号。体外细胞实验进一步证实了这一假设。
9、滤泡外B细胞形成免疫调节生态位,与人类癌症预后不良有关
鉴于滤泡外AtM B细胞和T细胞在TLSs内的空间共定位,进一步探索了AtM B细胞对T细胞的潜在影响(图6A)。刺激后,经过筛选的LIHC浸润的AtM B细胞比非AtM B细胞分泌更多的IL-10和转化生长因子- B (TGFb),表达更高的PD-L1,与对照相比,谷氨酰胺诱导的B细胞实验证实了这一点。用谷氨酰胺诱导外周B细胞进入AtM,并与外周CD3+ T细胞体外共培养。AtM B细胞可以减少CD4+和CD8+ T细胞的增殖(图6M),并损害T细胞产生IFNg、肿瘤坏死因子- a (TNFa)和颗粒酶B的能力(图N)。AtM B细胞促进T向Treg细胞和耗竭T细胞分化。
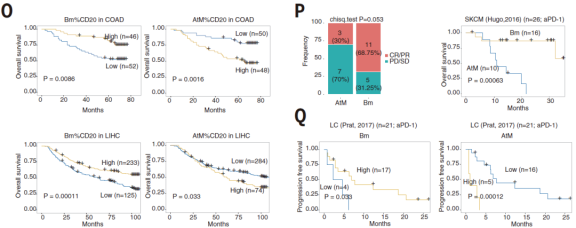
文章最后探讨了Bm和AtM B细胞在癌症中的预后价值。Bm细胞与良好的预后相关,而AtM B细胞则相反。此外,在接受抗pd1治疗的黑色素瘤(n = 26)和肺癌(n = 21)的已发表队列中,AtM B细胞的丰度与治疗耐药性显著相关,而Bm细胞与改善的应答和更长的生存期相关(图P和Q)。总的来说,这些观察结果表明,EF来源的B细胞与未成熟的TLSs和耗竭T细胞相关,导致某些癌症的免疫治疗耐药性和预后不良。
04 文章亮点和研究启示
(1)本文通过大规模单细胞测序技术编制了全面的泛癌B细胞图谱,深度解析了人类癌症中B细胞异质性和两种动态分化途径,为未来的研究提供了ASCs分化轨迹的基础参考;
(2)通过单细胞水平的多组学联合分析比较了EF和GC应答,揭示了不同癌症类型中B细胞状态的异同,突出了与EF通路相关的AtM B细胞免疫抑制微环境相关的不利临床结果;
(3)代谢-表观遗传网络非常灵活,锁定了关键代谢物谷氨酰胺衍生的代谢物α-酮戊二酸(α-KG),其可以增加AtM B细胞相关转录因子的表达,重新配置B细胞命运,从而促进B细胞靶向免疫疗法的发展。





