Celloger® Pro活细胞成像系统应用于脂肪生成的研究
脂肪细胞作为重要的能量储存库,能有效地将多余的卡路里转化为脂肪,以满足机体的能量需求。然而,过多的脂肪积累会导致肥胖,这是现代社会中与各种健康问题相关的一种状况[1]。除了在新陈代谢中发挥作用外,脂肪细胞还通过利用瘦素和脂联素等激素影响免疫反应和生殖功能[2]。
脂肪形成的过程,即前脂肪细胞分化为成熟脂肪细胞的过程,在不同物种之间是不同的。此外,体内组织和体外细胞中发生脂肪形成的细胞比例也不同[3]。研究人员正在积极探索脂肪形成的相关因素以及这一复杂过程背后的复杂调控机制。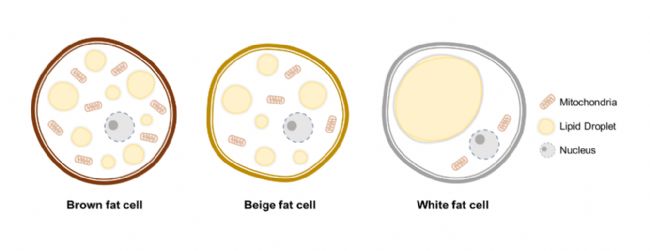
图1 三种类型的脂肪细胞
由Sylvia P. Poulos发表的一篇综述中表明,细胞的分化率随培养基成分的不同而不同。此外,与脂肪形成相关的转录因子的表达水平也随着时间的推移而变化。因此,评估不同时间点的脂肪形成程度是至关重要的。使用全自动活细胞成像设备,如Celloger® Pro,可以方便地监测和测量脂肪生成。
图2 Celloger® Pro 设备图
以下内容便详细介绍了通过Celloger® Pro来研究前脂肪细胞系3T3-L脂肪生成的方法。
设备实拍:
脂肪细胞的分化过程受到多种因素的高度调控和影响,包括前脂肪细胞的环境和药物干预[4、5、6]。其中,诱导分化时的细胞融合度被认为是影响脂肪细胞形成效率和质量的关键参数[7]。此外,药物制剂如罗格列酮,一种过氧化物酶体增殖物激活受体γ (PPARγ)的强效激动剂,已被证明在调节脂肪形成中发挥重要作用[8、9、10、11、12]。
因此,为了评估细胞初始密度如何影响脂肪细胞的分化,我们以四种不同密度播种3T3-L1细胞。此外为了确定罗格列酮对分化过程的影响,将实验分为两组,一组是含有罗格列酮的DM,另一组是不含罗格列酮的DM(图3)。
本次研究以下图为实验流程图,图内详细标注了各项处理因素以及处理时间点。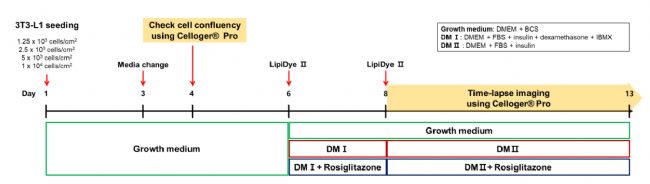
图3 实验流程图
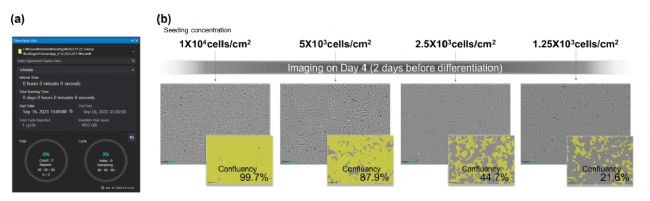
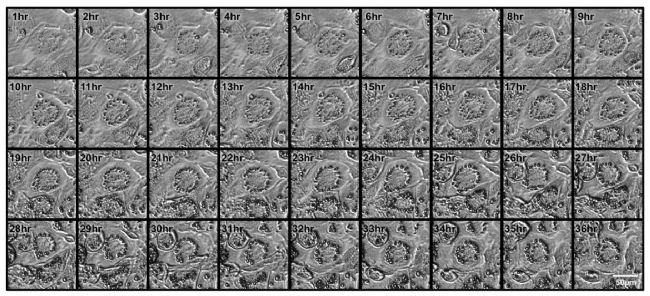
图5 脂肪细胞在分化过程中的延时成像
该Time-lapse显示DM II和罗格列酮处理后1小时至36小时每间隔1小时拍摄的图像 (使用10倍放大,裁剪图像)
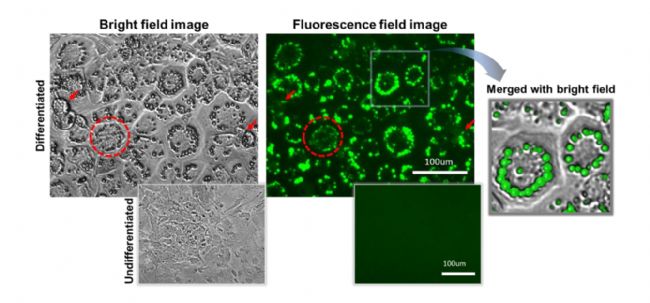
图6 脂肪细胞的脂滴在明场和荧光的成像
我们通过测量荧光覆盖率来量化分化率,荧光覆盖率表示脂滴所占的比例(图7)。由于分化不是均匀地发生在整个平板上,因此有必要检查广泛的区域进行综合分析。然而,使用低倍率(如2X)不足以精确测量小脂滴。因此,通过Celloger® Pro的拼接功能,我们可以在更宽的范围内测量脂滴的比例,获得更可靠的数据。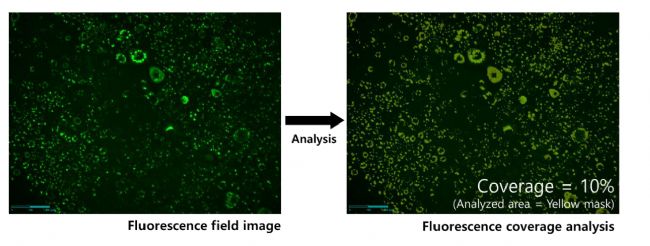
图7 使用Celloger分析软件测量脂滴面积
图8显示了添加或不添加罗格列酮DM II后第13天(图8a)和整个5天期间(从第8天到第13天)(图8b)观察分析到的结果。罗格列酮显著提高了脂肪细胞的分化率,荧光区增强表明脂肪堆积增加。未使用罗格列酮的DM II细胞在120小时后的分化率仅为4.7%。相反,用罗格列酮培养DM II细胞,细胞分化迅速增加,在97小时内细胞分化率达到16.6%。但不同浓度的细胞分化程度差异不大。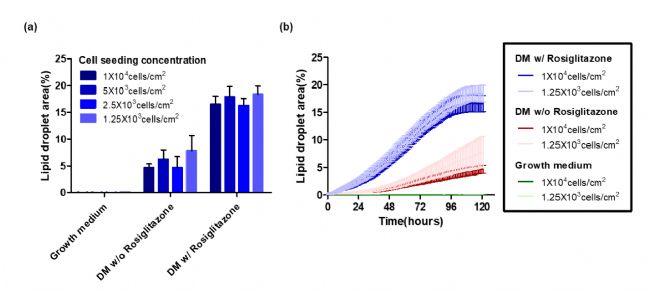
图8 脂滴面积的定量取决于细胞密度和罗格列酮给药
结论:
脂肪形成是一个复杂的过程,受多种因子的表达水平调控。理解这些复杂的机制需要长时间的细致观察。传统方法是,研究人员通过在分化过程中的特定时间点评估特定标记物的表达水平。然而,Celloger® Pro系统能够对这些通路进行连续、长期的监测,彻底改变了费时费力的传统监测方法。利用延时成像功能,研究人员可以在不受时间限制的情况下进行长时间的观测,从而提高实验效率。Celloger® Pro的一个显著特点是其拼接功能,保证既能清晰观察脂滴的形成又能捕获大范围的图像区域,以评估整体脂肪细胞分化。此外,通过对脂滴进行荧光染色,并利用Celloger®的分析软件测量荧光强度,研究人员可以量化分化程度,为观察到的变化提供数值。Celloger® Pro的应用为研究脂肪细胞分化的动态调控机制提供了新的研究方法,促进了我们对脂肪形成及其在代谢健康中的关键作用的理解。
参考文献:
1. Lennarz, William J., and M. Daniel Lane. “ Adipogenesis” Encyclopedia of biological chemistry. Academic Press, 2013. 52-56
2. Britannica, The Editors of Encyclopaedia. "adipose cell". Encyclopedia Britannica, 18 May. 2020, https://www.britannica.com/science/adipose-cell. Accessed 28 November 2023.
3. Poulos, Sylvia P ., Michael V . Dodson, and Gary J. Hausman. "Cell line models for differentiation: preadipocytes and adipocytes." Experimental biology and medicine 235.10 (2010): 1185-1193.
4. Benchamana, Ameena, et al. "Regulation of adipocyte differentiation and metabolism by lansoprazole." Life sciences 239 (2019): 116897.
5. Pu, Yong, and Almudena Veiga-Lopez. "PPARγ agonist through the terminal differentiation phase is essential for adipogenic differentiation of fetal ovine preadipocytes." Cellular & Molecular Biology Letters 22 (2017): 1-12.
6. T eixeira, Catarina, et al. "Enhanced 3T3-L1 differentiation into adipocytes by pioglitazone pharmacological activation of peroxisome proliferator activated receptor-gamma (PPAR-γ)." Biology 11.6 (2022): 806.
7. Cornelius, Peter, Ormond A. MacDougald, and M. Daniel Lane. "Regulation of adipocyte development." Annual review of nutrition 14.1 (1994): 99-129.
8. Farmer, S. R. "Regulation of PPARγ activity during adipogenesis." International journal of obesity 29.1 (2005): S13-S16.
9. Wabitsch, Martin, et al. "Characterization of a human preadipocyte cell strain with high capacity for adipose differentiation." International journal of obesity 25.1 (2001): 8-15.
10. T ontonoz, Peter, et al. "T erminal differentiation of human liposarcoma cells induced by ligands for peroxisome proliferator-activated receptor γ and the retinoid X receptor." Proceedings of the National Academy of Sciences 94.1 (1997): 237-241.
11. Zebisch, Katja, et al. "Protocol for effective differentiation of 3T3-L1 cells to adipocytes." Analytical biochemistry 425.1 (2012): 88-90.
12. Zhao, Xueyan, et al. "A comparison of methods for effective differentiation of the frozen-thawed 3T3-L1 cells." Analytical biochemistry 568 (2019): 57-64.
脂肪形成的过程,即前脂肪细胞分化为成熟脂肪细胞的过程,在不同物种之间是不同的。此外,体内组织和体外细胞中发生脂肪形成的细胞比例也不同[3]。研究人员正在积极探索脂肪形成的相关因素以及这一复杂过程背后的复杂调控机制。

图1 三种类型的脂肪细胞
由Sylvia P. Poulos发表的一篇综述中表明,细胞的分化率随培养基成分的不同而不同。此外,与脂肪形成相关的转录因子的表达水平也随着时间的推移而变化。因此,评估不同时间点的脂肪形成程度是至关重要的。使用全自动活细胞成像设备,如Celloger® Pro,可以方便地监测和测量脂肪生成。

图2 Celloger® Pro 设备图
以下内容便详细介绍了通过Celloger® Pro来研究前脂肪细胞系3T3-L脂肪生成的方法。
设备实拍:
脂肪细胞的分化过程受到多种因素的高度调控和影响,包括前脂肪细胞的环境和药物干预[4、5、6]。其中,诱导分化时的细胞融合度被认为是影响脂肪细胞形成效率和质量的关键参数[7]。此外,药物制剂如罗格列酮,一种过氧化物酶体增殖物激活受体γ (PPARγ)的强效激动剂,已被证明在调节脂肪形成中发挥重要作用[8、9、10、11、12]。
因此,为了评估细胞初始密度如何影响脂肪细胞的分化,我们以四种不同密度播种3T3-L1细胞。此外为了确定罗格列酮对分化过程的影响,将实验分为两组,一组是含有罗格列酮的DM,另一组是不含罗格列酮的DM(图3)。
本次研究以下图为实验流程图,图内详细标注了各项处理因素以及处理时间点。

图3 实验流程图
- 确定细胞融合度

图4 根据细胞接种密度确认细胞融合度
在接种细胞后,我们在第四天使用Celloger的延时成像功能评估它们的融合度。(a) cellloger扫描软件延时成像窗口 (b)分析细胞融合度的图像
- 观察细胞形态变化

图5 脂肪细胞在分化过程中的延时成像
- 观察脂滴形成与脂滴定量

图6 脂肪细胞的脂滴在明场和荧光的成像
我们通过测量荧光覆盖率来量化分化率,荧光覆盖率表示脂滴所占的比例(图7)。由于分化不是均匀地发生在整个平板上,因此有必要检查广泛的区域进行综合分析。然而,使用低倍率(如2X)不足以精确测量小脂滴。因此,通过Celloger® Pro的拼接功能,我们可以在更宽的范围内测量脂滴的比例,获得更可靠的数据。

图7 使用Celloger分析软件测量脂滴面积
图8显示了添加或不添加罗格列酮DM II后第13天(图8a)和整个5天期间(从第8天到第13天)(图8b)观察分析到的结果。罗格列酮显著提高了脂肪细胞的分化率,荧光区增强表明脂肪堆积增加。未使用罗格列酮的DM II细胞在120小时后的分化率仅为4.7%。相反,用罗格列酮培养DM II细胞,细胞分化迅速增加,在97小时内细胞分化率达到16.6%。但不同浓度的细胞分化程度差异不大。

图8 脂滴面积的定量取决于细胞密度和罗格列酮给药
结论:
脂肪形成是一个复杂的过程,受多种因子的表达水平调控。理解这些复杂的机制需要长时间的细致观察。传统方法是,研究人员通过在分化过程中的特定时间点评估特定标记物的表达水平。然而,Celloger® Pro系统能够对这些通路进行连续、长期的监测,彻底改变了费时费力的传统监测方法。利用延时成像功能,研究人员可以在不受时间限制的情况下进行长时间的观测,从而提高实验效率。Celloger® Pro的一个显著特点是其拼接功能,保证既能清晰观察脂滴的形成又能捕获大范围的图像区域,以评估整体脂肪细胞分化。此外,通过对脂滴进行荧光染色,并利用Celloger®的分析软件测量荧光强度,研究人员可以量化分化程度,为观察到的变化提供数值。Celloger® Pro的应用为研究脂肪细胞分化的动态调控机制提供了新的研究方法,促进了我们对脂肪形成及其在代谢健康中的关键作用的理解。
参考文献:
1. Lennarz, William J., and M. Daniel Lane. “ Adipogenesis” Encyclopedia of biological chemistry. Academic Press, 2013. 52-56
2. Britannica, The Editors of Encyclopaedia. "adipose cell". Encyclopedia Britannica, 18 May. 2020, https://www.britannica.com/science/adipose-cell. Accessed 28 November 2023.
3. Poulos, Sylvia P ., Michael V . Dodson, and Gary J. Hausman. "Cell line models for differentiation: preadipocytes and adipocytes." Experimental biology and medicine 235.10 (2010): 1185-1193.
4. Benchamana, Ameena, et al. "Regulation of adipocyte differentiation and metabolism by lansoprazole." Life sciences 239 (2019): 116897.
5. Pu, Yong, and Almudena Veiga-Lopez. "PPARγ agonist through the terminal differentiation phase is essential for adipogenic differentiation of fetal ovine preadipocytes." Cellular & Molecular Biology Letters 22 (2017): 1-12.
6. T eixeira, Catarina, et al. "Enhanced 3T3-L1 differentiation into adipocytes by pioglitazone pharmacological activation of peroxisome proliferator activated receptor-gamma (PPAR-γ)." Biology 11.6 (2022): 806.
7. Cornelius, Peter, Ormond A. MacDougald, and M. Daniel Lane. "Regulation of adipocyte development." Annual review of nutrition 14.1 (1994): 99-129.
8. Farmer, S. R. "Regulation of PPARγ activity during adipogenesis." International journal of obesity 29.1 (2005): S13-S16.
9. Wabitsch, Martin, et al. "Characterization of a human preadipocyte cell strain with high capacity for adipose differentiation." International journal of obesity 25.1 (2001): 8-15.
10. T ontonoz, Peter, et al. "T erminal differentiation of human liposarcoma cells induced by ligands for peroxisome proliferator-activated receptor γ and the retinoid X receptor." Proceedings of the National Academy of Sciences 94.1 (1997): 237-241.
11. Zebisch, Katja, et al. "Protocol for effective differentiation of 3T3-L1 cells to adipocytes." Analytical biochemistry 425.1 (2012): 88-90.
12. Zhao, Xueyan, et al. "A comparison of methods for effective differentiation of the frozen-thawed 3T3-L1 cells." Analytical biochemistry 568 (2019): 57-64.





