单细胞空间多组学助力在阿尔兹海默脑组织中鉴定新的小胶质细胞群体
编者按
阿尔兹海默症(AD)是一种神经退行性疾病,会导致认知能力下降。神经炎症是AD的病理特征之一,主要由小胶质细胞驱动。为了研究年龄和APOE基因型对小胶质细胞的影响,本文利用单细胞转录组、可及性检测和多重原位转录组检测技术,整合单细胞与空间组学数据,绘制了AD小胶质细胞图谱,鉴定出一种新的耗竭样小胶质细胞群体,解析其功能以及与AD进展的关系。
01 研究背景
阿尔兹海默症(AD)是一种无法治愈的神经退行性疾病,其特征是进行性突触功能障碍、神经元丢失和认知能力下降。β 淀粉样蛋白 (Aβ) 肽的过度积累和过度磷酸化tau蛋白的聚集是AD大脑的主要病理特征,其次是神经炎症,这被认为主要是由小胶质细胞驱动。小胶质细胞是经典神经炎症的中心介质,异质性高,以不同的状态存在于AD大脑中,可能对疾病进展有利或有害,然而决定特定小胶质细胞群是否限制或促进AD病理的因素仍然不明确。为了表征AD脑中小胶质细胞的变化,本文对不同年龄和不同APOE基因型小鼠脑中免疫细胞进行单细胞转录组和染色质可及性(ATAC)分析,结合多重原位转录组检测技术,系统地描绘了神经免疫系统的复杂动态,鉴定到一个新的炎症小胶质细胞群体,并多角度解析其特征和对AD发展的影响。
02 文章详情

文章题目:An exhausted-like microglial population accumulates in aged and APOE4 genotype Alzheimer's brains
中文题目:衰老和APOE4基因型阿尔茨海默症大脑中积累了耗竭样的小胶质细胞群
发表时间:2024.01
期刊名称:Immunity
影响因子:32.4
实验平台:10x Genomics单细胞转录组测序+ATAC+多重原位转录组检测
DOI:10.1016/j.immuni.2023.12.001
03 技术路线
为了方便各位老师快速掌握研究思路,小编绘制了文章的研究框架图,供各位观赏。
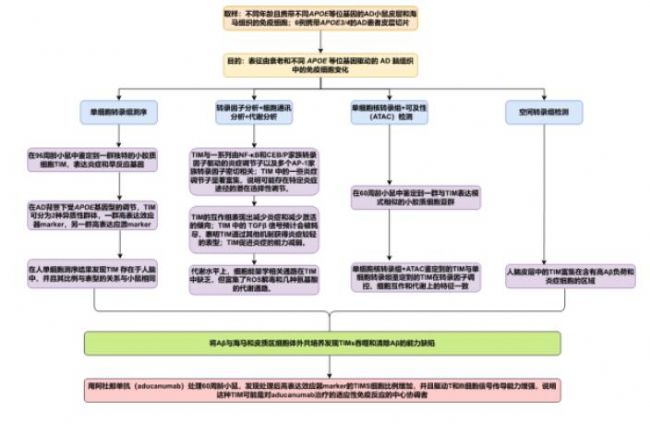
04 研究结果
1. 单细胞转录组测序在AD小鼠中鉴定到一个TIM细胞群
首先构建携带有不同APOE等位基因的AD小鼠,并对10、20和96周小鼠的海马和皮层组织进行取样、分选免疫细胞(CD45+)并进行单细胞转录组测序。细胞注释后将其中的小胶质细胞进行再聚类,发现一群高表达炎症和早反应基因的细胞,几乎仅存在于96周小鼠中,且在APOE4基因型中比例高于APOE3基因型。速率算法发现稳态小胶质细胞通过急性和慢性炎症小胶质细胞群向这一群年龄特异性小胶质细胞群流动。因此,研究者将这群细胞命名为终末炎症性小胶质细胞(TIM)。TIM可分为两个主要亚群,一个高表达效应器marker(effector-hi TIM),另一个则高表达应激marker(effector-lo TIM)。effector-lo TIM在APOE4基因型AD小鼠中比例更高,而effector-hi TIM在APOE2基因型小鼠中比例更高,说明TIM的异质性在AD环境中受APOE基因型调控。
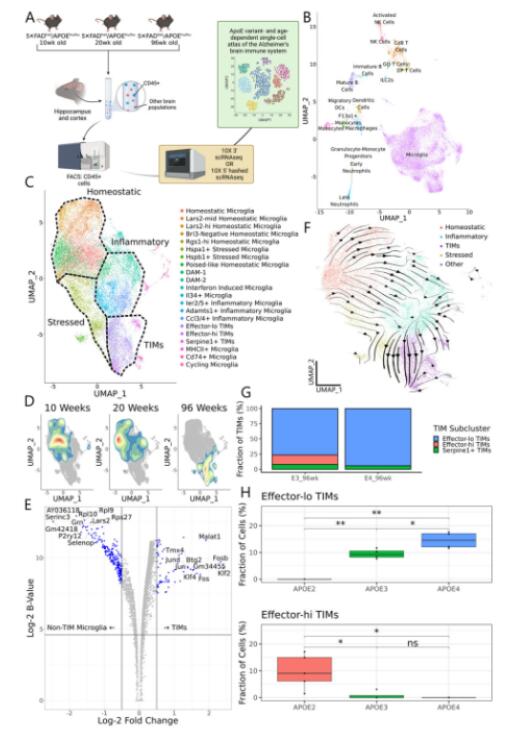
Fig.1 年龄和APOE基因型依赖的AD神经免疫图谱
2. TIM在转录调控、细胞通讯和代谢方面的特征
利用SCENIC算法确认TIM的驱动转录因子,发现TIM与核因子(NF)-kB和CEB/P家族转录因子驱动的一系列炎症调控因子以及多个AP-1家族转录因子密切相关。相对于稳态小胶质细胞,TIM在一些炎症调控因子(Nfkb2、Irf1、Irf3和Irf4)中富集,但在其他因子(Irf5、Irf7、Irf9和Stat1/2)中减少,表明可能有特定炎症途径的潜在选择性调节。
利用CellPhoneDB分析小胶质细胞与其他免疫细胞间的通讯关系,发现TIM表现出减少炎症和降低激活的倾向。TIM中的TGF-β信号相对于疾病相关小胶质细胞(DAM)和稳态小胶质细胞减少,表明TIM通过其他机制获得炎症减轻的表型。此外,在微环境中,TIM促进炎症的能力减弱。
利用Compass分析发现细胞能量代谢通路、糖酵解/糖异生途径以及糖类的代谢通路在TIM中减少,而与活性氧(ROS)解毒和多种氨基酸代谢相关的通路在TIM中增加。
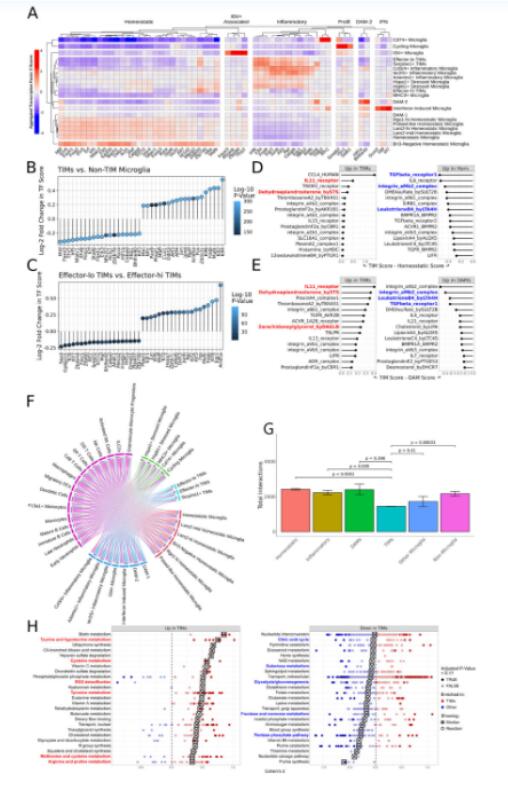
Fig.2 TIMs由独特的转录程序、相互作用和代谢状态定义
3. 单细胞多组学揭示TIM转录调控的介质
为了补充从20到96周龄小胶质细胞的发育特征,并且从转录组和转录调控两个组学来表征小胶质细胞,研究者利用单细胞核转录组和ATAC检测技术分析60周龄AD小鼠海马和皮层组织的免疫细胞,发现有一个小胶质细胞亚群表达模式与TIM相似,其比例高于20周龄小鼠,低于96周龄小鼠,说明TIM在60周龄时已经以较高水平可检测,并且随后以年龄依赖的方式继续积累。TIM的marker基因在表达和可及性方面具有高度一致性。对ATAC结果进一步分析发现ETS转录因子家族特异性富集于TIM中。此外,SCENIC+、CellPhoneDB和Compass的分析结果表明,60周龄与96周龄的TIM在转录调控、细胞互作和代谢上特征一致。
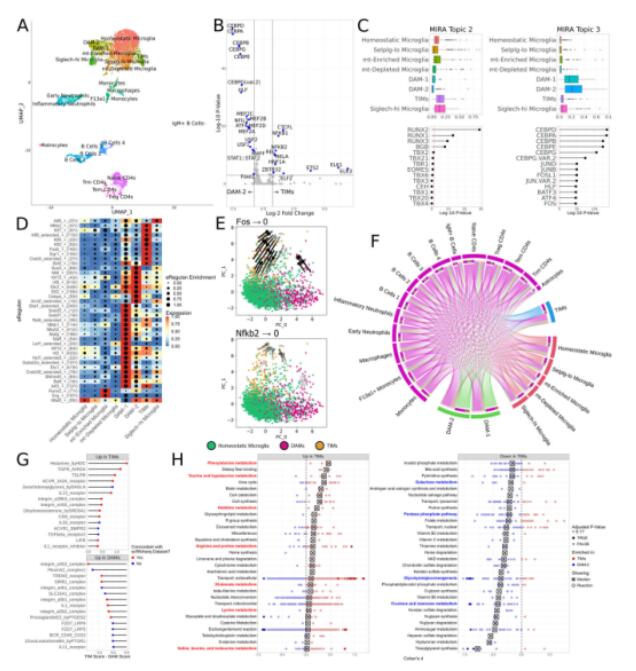
Fig.3 60周龄AD*APOE4小鼠的单细胞转录组+ATAC测序表明TIMs的调控特征
4. TIM存在于晚期AD患者中,并随着年龄和APOE4增加而增多
为了确认在小鼠中发现的TIM是否真实存在于人脑中,研究者对已发表的人脑单细胞核转录组测序结果的小胶质细胞进行分析,并成功鉴定到TIM的存在,在AD患者中比例高于健康人,并随着布雷克分级(衡量AD进展的组织病理学指标)增加而增加。携带APOE4等位基因的患者比APOE3/APOE3患者的TIM比例更高。建模分析表明,布雷克分级和APOE4等位基因计数是TIM比例的强预测因子。在一个小鼠跨年龄单细胞转录组图谱中发现TIM的比例随年龄增加而增加。
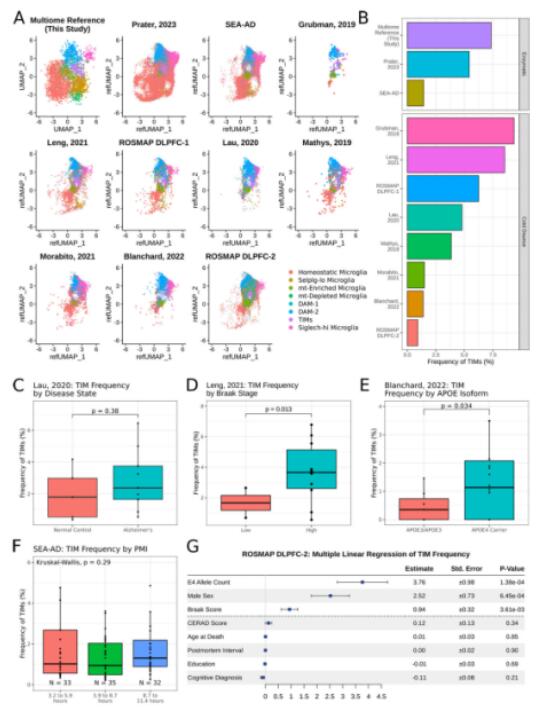
Fig.4 TIM存在于公开的人单细胞核转录组测序数据集
5. 脑皮层中TIM分布区域富含Aβ斑块和炎性细胞
为了确认空间水平上TIM的分布特征,研究者利用多重原位转录组检测技术对6位AD患者(3位APOE4纯合子和3位APOE3纯合子)切片进行分析。其中,APOE4纯合子中TIM比例更高,空间邻域分析发现TIM与TIM、L5神经元和两种特定的星形胶质细胞相邻概率更高。APOE4中的 TIM 更有可能与神经元和这两个星形胶质细胞群聚集,而APOE3 中的 TIM 更可能与少突胶质细胞(多数位于白质中)相邻,说明APOE4基因型与 TIM比例增加以及这些TIM与灰质更接近相关。此外,在含有高Aβ的区域中检测到TIM,表明 TIM 在Aβ相关发病机制中具有潜在作用。
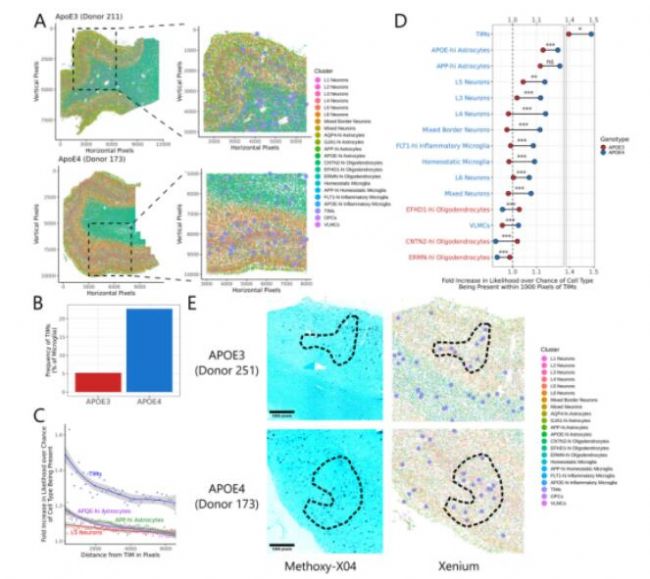
Fig.5 TIM富集在携带 APOE4 的AD 患者的皮质层中
6. TIM的Aβ吞噬和清除能力缺陷
接下来,研究者将60周龄不同APOE基因型的AD小鼠海马和皮层中的细胞与荧光标记的Aβ体外共培养、分选(CD45+),并根据荧光信号高低分为2管(荧光信号高说明细胞吸收Aβ的量高,反之则低),进行单细胞转录组测序。结果表明,Aβ吸收少的细胞群体向TIM靠拢,Aβ吸收高的细胞群体中effector-lo和effector-hi TIM比例低,且在APOE4基因型中effector-lo更低,说明该基因型中该细胞群体的 Aβ 清除缺陷更加严重,导致该基因型患者负担更重的复合效应。
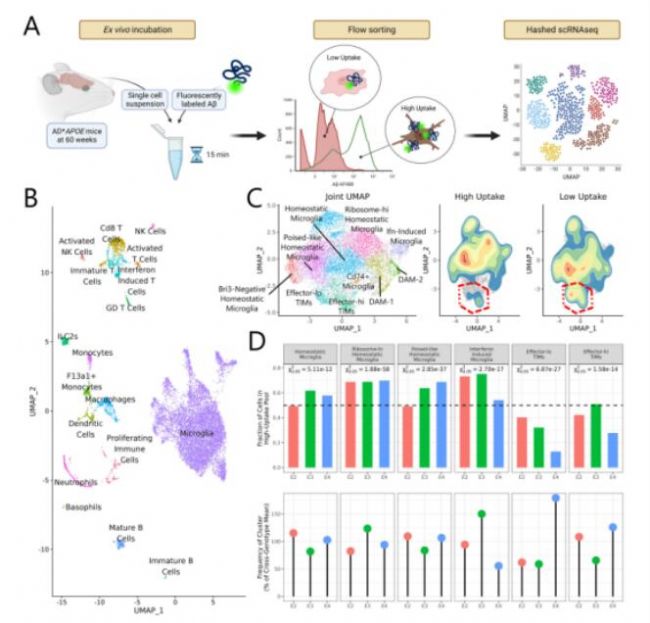
Fig.6 TIM的Aβ清除功能受损
7. 阿杜那单抗治疗可调节 TIM 的比例和相互作用
阿杜那单抗通过选择性结合Aβ聚合体来减缓疾病进展。为了剖析该药物如何影响晚期疾病中TIMs的出现和行为,研究者给60周龄的AD小鼠注射阿杜那单抗或同种型对照并进行单细胞转录组测序,发现effector-hi TIM在药物处理组比例更高,而effector-lo TIM在对照组比例更高。互作分析发现阿杜那单抗治疗和 APOE4 均与预测的相互作用更多和平均预测相互作用强度越高相关,阿杜那单抗治疗在APOE2中较难驱动小胶质细胞对Aβ的反应,而在APOE3/4中则相反。在免疫细胞互作关系中,治疗作用显著增加了适应性免疫细胞总相互作用,且在APOE4中增加更多。与B和T细胞的互作信号中,信号增长最大的是effector-hi TIM,表明这种细胞在协调炎症期间的细胞间通信网络时可能特别关键,effector-hi TIM可能是对aducanumab治疗的适应性免疫反应的中心协调者。
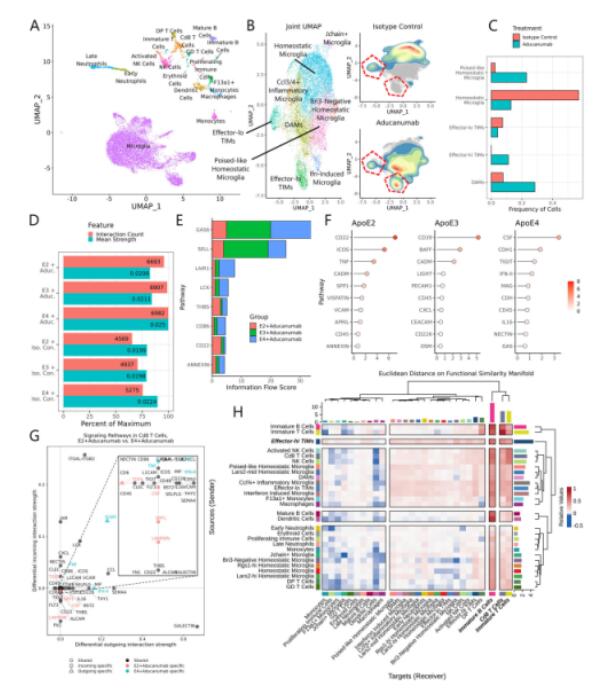
Fig.7 阿杜那单抗治疗深刻改变了AD环境中免疫细胞的格局
05 主要结论
本研究在携带三种常见人 APOE 等位基因的AD模型小鼠中生成了脑免疫细胞的综合纵向单细胞图谱。转录组和染色质可及性分析确定了一个反应性小胶质细胞群体,其表达炎症信号和细胞内在应激marker,比例随着年龄和 APOE4 负担而增加。使用多重原位转录组技术在AD患者的大脑中检测到类似的群体,包括在皮质组织中。这一群体被命名为终末炎症小胶质细胞 (TIM),在阿杜那单抗治疗期间表现出Aβ清除缺陷和细胞间通讯改变。TIM 可能代表 AD 环境中炎症小胶质细胞的类耗竭状态,导致APOE4携带者和老年人的 AD 风险和病理,从而为 AD 提供潜在的治疗靶点。
参考文献:
Millet, Alon et al. “An exhausted-like microglial population accumulates in aged and APOE4 genotype Alzheimer's brains.” Immunity vol. 57,1 (2024): 153-170.e6.





