NC新发现,FPB1蛋白促进光系统II的组装
2024年4月10日,Nature Communications在线发表上海师范大学彭连伟教授实验室题为Thylakoid protein FPB1 synergistically cooperates with PAM68 to promote CP47 biogenesis and Photosystem II assembly的研究论文,文章揭示了一个新的蛋白质FPB1(Facilitator of PsbB biogenesis1),它在PSII的组装中扮演着重要角色,它是PSII积累所必需的。本研究中,光合作用相关的叶绿素荧光成像和P700氧化还原差示吸收通过MAXI-IMAGING-PAM和DUAL-PAM-100完成。
◆ fpb1突变体中PSII的积累显著减少
◆ FPB1突变体中叶绿体编码的psb转录水平不降低,但与psbB的多聚核糖体结合增强
◆ FPB1对CP47的合成和PSII的组装有影响
◆ fpb1突变体中PSII组装受阻
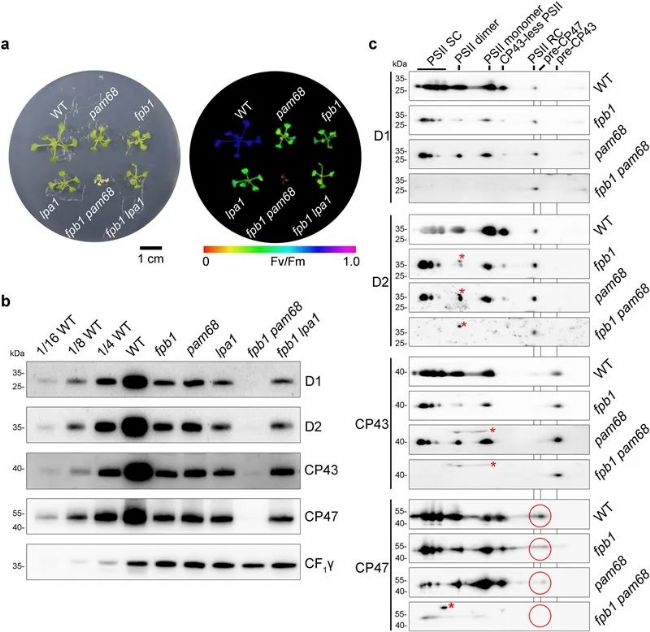
◆ PAM68中CP47的合成速率也降低
◆ 在fpb1 pam68双突变体中,PSII的积累完全被废除
◆ FPB1是一个具有未知功能的类囊体膜蛋白
◆ FPB1与PAM68、Alb3和SecY1相互作用
◆ fpb1和pam68中的psbB翻译延伸受阻
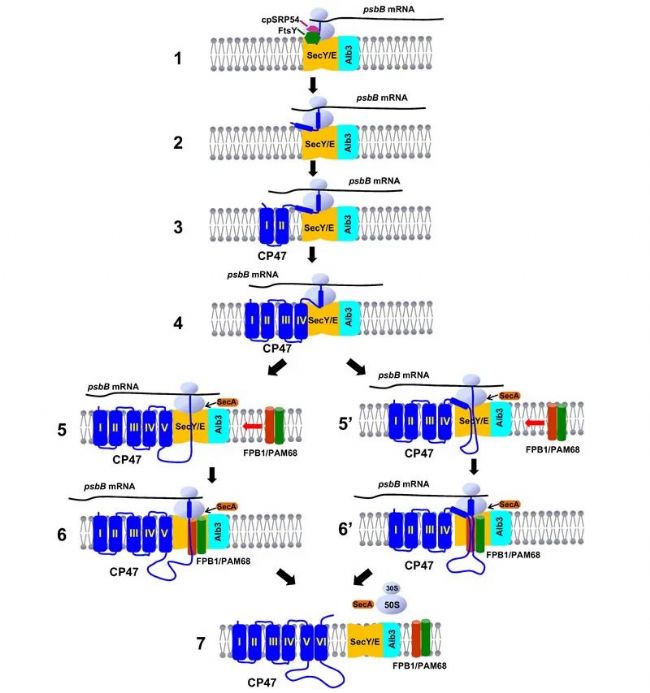
◆ 叶绿体中CP47的共翻译组装以及FPB1和PAM68功能的可能模型
研究人员通过遗传和生化实验发现,FPB1与已知的PAM68蛋白协同作用,共同促进了CP47—PSII核心亚基的生物合成。在缺乏FPB1和PAM68的情况下,CP47的合成速率降低,且无法形成功能性的PSII复合体,导致植物无法进行有效的光合作用。
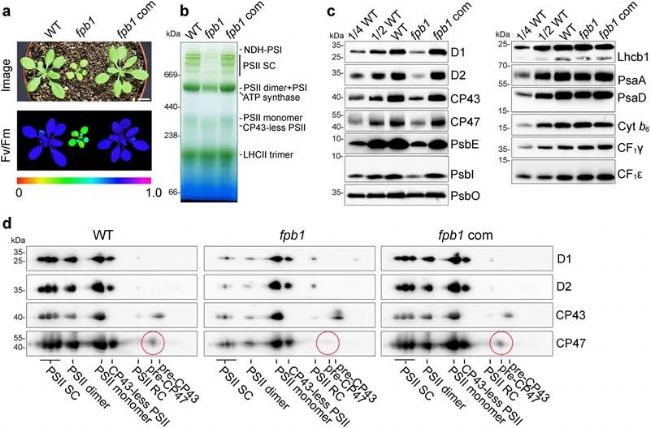
这项研究还发现,FPB1是一种位于叶绿体内膜的蛋白质,它与PAM68、SecY/E转位子和Alb3整合酶相互作用,可能协助CP47在翻译过程中顺利嵌入叶绿体内膜。此外,通过核糖体剖析技术,研究人员观察到在没有FPB1和PAM68的情况下,核糖体在翻译CP47时出现明显的暂停,这表明这两个蛋白在促进CP47的共翻译插入中起着关键作用。
本研究提出了叶绿体中CP47的共翻译组装以及FPB1和PAM68功能的可能模型。
成果总结
在该项工作中,研究人员鉴定并描述了光合真核生物在进化过程中获得的PSII生物发生因子FPB1。研究结果所提供的遗传和生化证据表明,FPB1与之前发现的组装因子PAM68 相互作用,它们在PSII组装过程中协同协调CP47的生物发生。CP47被认为是以共翻译方式插入类囊体膜的。通过与SecY/E易位子机制和Alb3整合酶相互作用,FPB1和PAM68 有可能促进CP47的最后两个跨膜结构域和连接环以共翻译方式整合到类囊体中,然后再整合到 PSII 核心复合物中。
上海师范大学生命科学学院植物种质资源开发中心的张琳副研究员,阮俊祥博士为论文的共同一作,彭连伟教授为论文的通讯作者。本研究得到了上海市自然科学基金和上海市植物种质资源工程研究中心的支持。—— 原文 ——
Zhang, L., Ruan, J., Gao, F., et al. Thylakoid protein FPB1 synergistically cooperates with PAM68 to promote CP47 biogenesis and Photosystem II assembly[J]. Nature Communications, 15, 3122 (2024).
如您需要了解更多信息,请识别下方二维码填写登记表,我们会为您提供专业的服务,真诚期待与您的合作!

电话:021-32555118
邮箱:sales@zealquest.com






