通过生物打印液滴和环形结构体开发胶原蛋白收缩试验的过程与结果
在过去的几十年里,胶原凝胶收缩实验被广泛用于研究 生物力学过程、组织修复机制和3D疾病模型。收缩试验 的典型程序包括人工将胶原蛋白浇铸入孔中,聚合和分 离。3D生物打印为许多基于收缩的分析和细胞培养模型 的自动化提供了一条途径,因为它允许自动分配胶原蛋 白,精确的体积和图案控制,直接在加热的打印上进行热聚合,并通过自动释放板涂层剥离凝胶。
在这项研究中,使用BIO ONE生物打印嵌入人真pi成纤维细胞的胶原液滴和胶原环,并在有血清和不含血清 的生长培养基中监测48和72小时。结果表明,生物打印的胶原蛋白结构具有较高的细胞活力,随着细胞浓度和血清水平的增加,收缩率随时间的推移而增加。这表明,3D 生物打印在简单和复杂的生物力学分析中都具有加速自动化的潜力。
概述
胶原凝胶收缩(CGC) 试验zui早出现在四十年前 (Bell ,1979年),在了解不同的生物力学过程中发挥了重要 作用。CGC 试验利用了细胞填充的3D胶原水凝胶随时间发生的可预测和一致收缩的优势Ngo,2006 年 ) 。
组织收缩是发生在各种组织重塑和疾病途径中的重要活动 (Al-Kofahi,2015;Dickman,2019;
Matsumoto,2007)。 例如,淋巴系统参与动态的强 直性和阶段性收缩,以维持体内平衡。在重现机械组织 功能、研究新疗法和疾病通路时,该技术可替代结构不合适的2D细胞培养和不可持续的动物模型(Al-Kofahi,2015)。
一般来说,3D细胞培养能更好地支持细胞与细胞之间的 相互作用,与2D细胞培养相比,3D细胞培养能在细胞形 态、连接蛋白、氧合作用以及药物和营养吸收方面表现出更多相关的生理差异(Murphy,2014;Pampaloni,2007;Edmondson,2014) 。胶原凝胶为在3D环境 中研究机械生物学创造了理想的微环境,因为胶原凝胶 会根据细胞可溶性因子的释放情况改变收缩率,从而为疾病的进展提供线索(Zhang,2019) 。
然 而 ,CGC分析工作流程仍存在一些问题,如需要大量细胞(Redden,2003年)和过度消耗昂贵的胶原蛋白(96孔板中每个重复>100μL)(Gullberg,1990年 ;Timpson,2011年)。相比之下,3D生物打印技术可在 胶原蛋白用量较少的情况下对敏感细胞类型进行经济可 行的生物力学筛选,甚至在胶原蛋白形态复杂的情况下对强健细胞类型进行生物力学筛选(Nerger,2019年)

材料和方法
细胞制备
新生儿人真pi成纤维细胞(ndfs) 购 自PromoCell, 并按 照供应商的方案进行培养。NHDFs 在无血清(SF) 成纤维 细胞生长培养基中生长,冷冻前加入补充混合物(PromoCell,Ref #C-23010)和1%青霉素链霉素(Gibco,Ref#15070-063)。
在打印之前,将细胞解冻 并混合在生物墨水中而不膨胀。打印后, 一半的样品在 添加10%胎牛血清(FBS) 的培养基中培养(Gibco,Cat #16000044)。
生物墨水制备和生物打印液滴: Coll1(CELLINK,Ref #IKD119261001) 根据 CELLINK 的协议制备用于生物打印。 Coll1 与0,40,000 或400,000 个细胞在培养基中混合,最终胶原蛋白浓度为 2 mg/ mL。 将混合物装入冷却的 3 ml 注射器 (BD,Ref#309658) ,加盖27gnozzle (CELLINK,Ref#NZ4270005001) , 并置于冷却的打印头中,温度为 4°C ,用于液滴打印。 使用BIO ONE(CELLINK, #CL-BP-ONE-G1)上的液滴打印功能,在未经处理的48孔板(VWR, Ref #7342780)上以23µL
液滴的形式打印生物墨水,挤出速度郑OμL/s, 缩回体 积为7μL。打印完成后,将Coll 液滴在37℃培养箱中热交联60分钟,每孔加入100μL培养基。6小时后,使用抹刀将液滴从井底分离,并获取图像。
环形: 两个12孔板(VWR,Ref #7342778) 按照制造商的说明涂有 Sigmacote(Sigma-Aldrich,Ref #SL2),以促进胶原环脱落。将 CELLINK Pluronics 40%(CELLINK,Ref #IKS40000O503) 装入冷却的3ml 注射器中,用25G 喷嘴(CELLINK,Ref #NZ4250005001) 盖上,并置于冷却的打印头中,温度为2℃。使用墨水在两个涂层孔板上打印牺牲环屏障 ,设置为:37°℃打印床,5mm/s 打印速度,23μL预流量 ,1.3μL 挤出速度,25μL 收缩体积,0 mm z偏移,10μ L额外预流量,100%填充挤出倍率,60μL/s 收缩速度 ,10μL额外收缩,O s后流停止时间和2 mm z提升。用 于打印环的胶原蛋白是高质量的1型大鼠尾端胶原蛋白。 将胶原蛋白中和后与100万个细胞混合,或不与细胞混 合作为对照,使胶原蛋白最终浓度为3mg /mL。将混合物装入冷却的3ml 注射器中,注射器上盖有25G喷嘴,在人工屏障内分配45μL。请参见图2中的STL文件说明 和完成的打印。将打印物加热至37℃,使胶原蛋白热凝 胶5分钟。 凝胶化后,将板置于冰上1分钟,使Pluronics冷却,加入1mL 冷却培养基。不能自动分离的 环用抹刀小心地从井底分离出来。Pluronics溶解后,取 出培养基,加入新的热培养基。将两个板置于加湿培养箱中,并在72小时内的四个时间点获取图像。
图像分析
生物打印胶原蛋白结构的图像是用手机(三星galaxy 9, 1200万像素)拍摄的液滴,用三脚架上的数码单反相机(尼康,1620万像素)拍摄的环。对于液滴,使用图像处

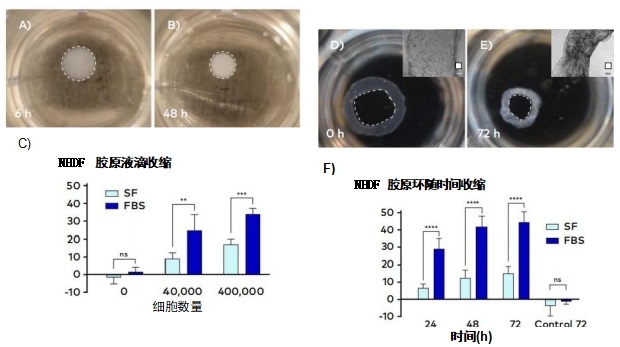
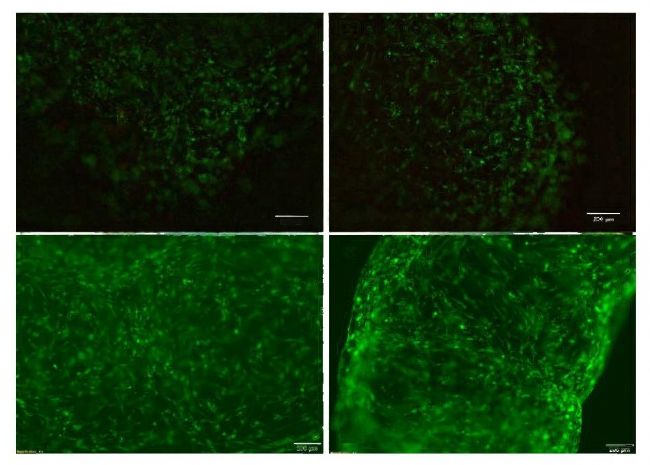
理程序ImageJ(n=5) 测量直径,以井底直径为参考。分别在孵育6小时和48小时后捕获液滴凝胶图像。 48小 时后测量凝胶表面直径,直径变化量为凝胶直径除以6小 时后测量的初始凝胶表面直径。对于环,使用image7 测 量内部空间的面积,并从中提取直径(SF n=7,FBS n=5, control n=5)。在孵育0、24、48和72小时后捕获环的图像,卷曲的环从研究中省略。72h后,直径变化为凝胶直径除以打印后直接测得的初始凝胶直径。 根据CELLINK 的Calcein AMandPI活性染色方案,使用Calcein AM(Invitrogen eBioscience,Ref #15560597)和碘化丙啶(Sigma-Aldrich,Ref #81845-25MG)染色来评估48和72小时后的细胞活力。使用荧光显微镜(Olympus IX73)使用绿色(FITC) 和红色(XRED) 通道获取图像。采用ImageJ 评估细胞活力。采用非配对t 检验(Prism 8,GraphPad Software)评估各组数据之间的差异。
结果和讨论
FBS 调理增加了生物3D 打印胶原液滴和胶原环的收缩百 分比。在含FBS 的培养基中孵育后,可以观察到液滴和 环内径明显减小(图3 A-b,D-E)。 当比较SF 培养基中的 凝胶直径和添加FBS 的凝胶直径时,可以观察到液滴和 环的显著差异(图3 C,F)。 这可以归因于成纤维细胞在 FBS 存在下的增殖特性。此外,在胶原凝胶中培养的成 纤维细胞倾向于获得双极纺锤体结构和多分支形态,这 有助于强直性收缩(Mochitate,1991) 。 通常,当在胶原 凝胶中生长时,成纤维细胞产生的胶原蛋白减少,而蛋 白酶和纤维连接蛋白水平增加。因此,诸如细胞数量增加、肌动蛋白丝束和表面纤维连接蛋白增加等指标也可 归因于凝胶收缩(Mochitate,1991)。钙黄素 AM 和碘化丙烯染色的细胞活力显示,在 FBS 的存在下,细胞的双极分支模式更加明显(图4)。此外, FBS 的存在也与 4 8 和 7 2 小时后更高的细胞活力相关,所有条件下的细胞活力都超过 95%。
这一结果是意料之中的,因为FBS是一种成熟的细胞生 长补充剂。在缺乏FBS 的胶原凝胶中也观察到超过75% 的活细胞存活率,这进一步支持了生物打印在非理想生 长补充中的应用。总的来说,生成的数据支持将3D 生物 打印用于简单的小体积自动收缩分析,并显示出在更复杂的途径识别分析中使用的潜力。
未来的研究可能会结合1.DOT给药和CELLCYTE XW显微镜 的收缩跟踪,以实现完全优化的自动化工作流程。此外 ,其他特征或模式可以集成到打印协议中,例如打印传 感器或柱子,以诱导机械应变并通过收缩环进行传感。
结论
经过验证, BIO ONE 是一种适用于中高通量、低容量、高细胞活力生物力学试验的有用工具。胶原液滴和胶原环的收缩率与细胞密度和FBS 调节有关。
通过3D 生物打印,可以调整分配的体积,以最佳地利用有价值的细胞和材料。BIO ONE打印头的冷却功能允许自动和精确地分配 细胞胶原蛋白。在这项研究中,与传统的铸造全孔板的方法相比,胶原蛋白液滴的消耗减少了800%以上。打印PLURONICS 支持屏障允许更复杂的胶原蛋白图案,并可以产生各种形状。
参考文献
1. Bell,E.,Ivarsson,B.,and Merrill,C.Production of a tissue-like structure by contraction of collagen lattices by
human fibroblasts of different proliferative potential in vitro.Proceedings of the National Academy of Sciences of the United States of America.1979;76(3):1274-1278. DOl:10.1073/pnas.76.3.1274.
2. Al-Kofahi,M.,Becker,F,Gavins,F.N.,et al.IL-1 reduces tonic contraction of mesenteric lymphatic muscle cells, with the involvement of cycloxygenase-2 and prostaglandin E2.British Journal of Pharmacology.2015;172(16): 4038-4051. DOl:10.1111/bph.13194.
3. Dickman,C.T.D.,Russo,V.,Thain,K.,et al.Functional characterization of 3D contractile smooth muscle tissues generated using a unique microfluidic 3D bioprinting technology.The FASEB Journal.2019;34:1652-1664. DOI: 10.1096/fj.201901063RR.
4. Matsumoto,H.,Moir,L.M.,Oliver,G.G.,et al.Comparison of gel contraction mediated by airway smooth muscle cells from patients with and without asthma.Thorax.2007;62:848-854.DOI:10.1136/thx.2006.070474 .
5. Ngo,P.,Ramalingam,P.,Phillips,J.A.,Furuta,G.T.Collagen gel contraction assay.Cell-Cell Interactions.2006; 341:103-109. DOl:10.1385/1-59745-113-4:103.
6. Zhang,T,Day,J.H.,Su,X.,et al.Investigating fibroblast-induced collagen gel contraction using a dynamic
microscale platform.Frontiers in Bioengineering and Biotechnology.2019;7:196. DOl:10.3389/fbioe.2019.00196.
7. Murphy,S.V.,and Atala,A.3D bioprinting of tissues and organs.Nature Biotechnology.2014;32(8):773-785.DOI: 10.1038/nbt.2958.
8. Pampaloni,F.,Reynaud,E.G.,and Stelzer,E.H.The third dimension bridges the gap between cell culture and live tissue.Nature Reviews:Molecular Cell Biology.2007;8(10):839-845. DOl:10.1038/nrm2236.
9. Edmondson,R.,Broglie,J.J.,Adcock,A.F.,et al.Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors.Assay and Drug Development Technologies.2014;12(4):207-218.DOI: 10.1089/adt.2014.573.
10.Redden,R.A.,and Doolin,E.J.Collagen crosslinking and cell density have distinct effects on fibroblast-mediated contraction of collagen gels.Skin Research and Technology.2003;9:290-293.DOl:10.1034/j.1600- 0846 2003 00023 x
11.Gullberg,D.,Tingstrom,A.,Thuresson,A.C.,et al.b1 integrin-mediated collagen gel contraction is stimulated by PDGF.Experimental Cell Research.1990;186:264-272. DOI:10.1016/0014-4827(90)90305-t .
12.Timpson,P.,McGhee,E.J.,Erami,Z.,et al.Organotypic collagen l assay:A malleable platform to assess cell behavior in a 3-dimensional context.Journal of Visualized Experiments.2011;56:e3089. DOI:10.3791/3089 .
13.Nerger,B.A.,Brun,P.T.,Nelson,C.M.Microextrusion printing cell-laden networks of type I collagen with patterned fiber alignment and geometry.Soft Matter.2019;15:5728-5738.DOl:10.1039/C8SMO2605J .
14.Mochitate,K.,Pawelek,P.,and Grinnell,F.Stress relaxation of contracted collagen gels:Disruption of actin filament bundles,release of cell surface fibronectin,and down regulation of DNA and protein synthesis.
Experimental Cell Research.1991;193:198-207.DO:10.1016/0014-4827(91)90556-a .





