空间多组学技术助力肿瘤新疗法开发
空间多组学技术,是近年来逐渐兴起的分子组学研究技术,与传统的组学技术相比,在检测基因、蛋白质、代谢物表达水平的同时,获得其空间位置信息。此外,将这些数据结果与病理图像信息相结合,便可探究疾病发展过程中重要区域内的分子表达、细胞分布及信号通路的变化特征。2022年,Nature Methods将空间多组学技术评为年度技术,足见其在生物学研究中发挥的重要作用。因此,为了让大家能掌握空间多组学的研究思路,小编带来了一篇Matthias Mann教授团队的文章,以空间蛋白质组+空间转录组为例,看空间多组学技术如何应用于肿瘤新疗法的开发工作。
文章题目:Spatial proteo-transcriptomic profiling reveals the molecular landscape of borderline ovarian tumors and their invasive progression
中文题目:空间蛋白质转录图谱揭示交界性卵巢癌及其侵袭性进展的分子特征
发表时间:2023.11.13
期刊名称:medRxiv
影响因子:无
实验平台:LCM+timsTOF SCP+GeoMx DSP
DOI:10.1101/2023.11.13.23298409
研究背景
浆液性交界性肿瘤(SBT)是卵巢的上皮性肿瘤性病变,通常预后良好。然而,在10-15%的病例中,SBT会复发为低级别浆液性癌(LGSC),这种肿瘤具有很深的侵袭性,对当前标准的化疗方案应答很差。虽然基因改变表明有共同的起源,但从SBT到LGSC的转变仍然难以理解。因此,本研究借助空间蛋白质组和空间转录组的力量,探究SBT向LGSC的侵袭性转化过程中蛋白质/转录本表达及信号通路的变化信息,寻找更有效的治疗方法。
技术路线
为了方便各位老师快速掌握研究思路和结果,小编绘制了文章的研究框架图,供各位观赏。
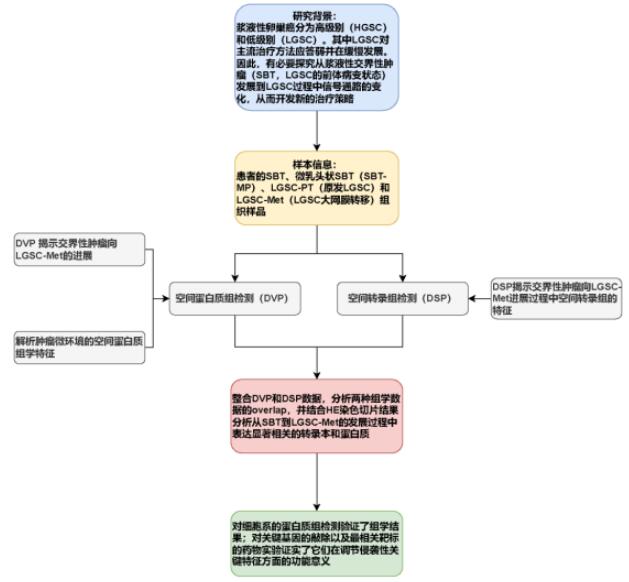
组织类型:患者组织切片,包括SBT、微乳头状SBT(SBT-MP)、原发LGSC(LGSC-PT)和转移LGSC(LGSC-Met)四个疾病阶段的样品。
空间蛋白质组(DVP)检测方法:使用 nucleAIzer AI算法在切片上分割细胞群,并结合激光捕获显微切割技术(LCM)和高灵敏度的4D质谱仪timsTOF进行切割捕获和蛋白质组分析。
空间转录组(DSP)检测方法:使用GeoMx DSP技术分析切片中感兴趣区域(ROI)的转录组信息。
研究结果
1. DVP 揭示交界性肿瘤向LGSC-Met的进展
对上皮组织空间蛋白质组学结果进行PCA分析发现四种阶段的肿瘤组织能够有序的聚类,并且微乳头状生长是非侵袭性SBT和侵袭性低级别肿瘤的中间阶段。线性回归分析,确定了在侵袭性表型中195个蛋白质的上调和下调,代表了从SBT到LGSC及相应癌转移的转变过程。具有微乳头状特征的SBT作为LGSC复发的风险较高。然而,关于SBT-MP是否是LGSC的前体存在争议。DVP数据表明,SBT-MP和SBT的蛋白质表达在代谢方面发生显著变化,AHDC1 和 ERF以及与肿瘤干性相关的蛋白质在SBT-MP中上调,而肿瘤抑制因子则下调。整体而言,SBT-MP的蛋白质表达更类似于SBT,但在多个方面反映了恶性转化的特征。MAPK信号通路在LGSC和SBT中发生了改变,ERK1/2和Met信号在LGSC中富集。此外,TGF-β信号通路下游的多个蛋白质在SBT-MP或LGSC中逐渐上调。大多数SBT和LGSC表达激素受体,在抗激素治疗上具有暂时的响应性。从SBT到SBT-MP时孕激素结合蛋白PGRMC2逐渐增加,表明孕激素在早期向LGSC过渡过程中发挥作用。此外,一些蛋白质的表达随着阶段发展发生变化,如PAX8、CAPS等,在SBT中表达,但在LGSC中逐渐丧失,NOVA2在LGSC中表达,但在SBT和SBT-MP中不表达。
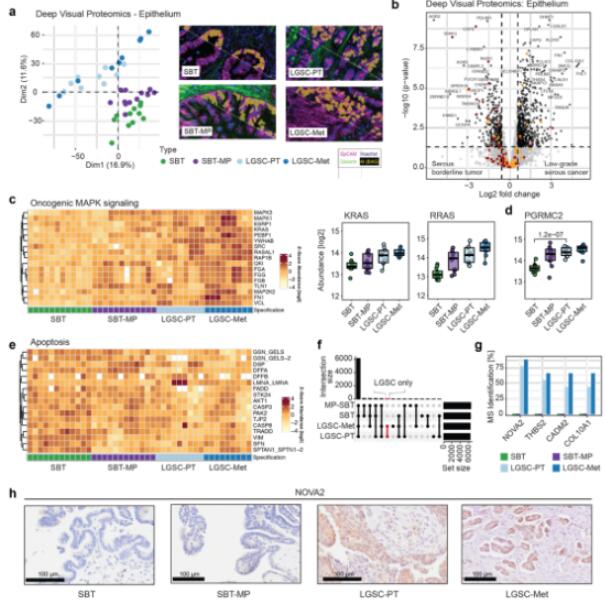
Fig.1 肿瘤上皮区的空间蛋白质组分析鉴定SBT向LGSC转变的新途径
2. 肿瘤微环境的空间蛋白质组学分析
在基质细胞中,从SBT到LGSC过程中,发现178种蛋白质显著变化。PCA分析表明SBT和SBT-MP的蛋白质表达谱与LGSC及其相应的转移存在明显区别,与上皮区域不同,SBT和SBT-MP的基质非常相似,没有向LGSC过渡的中间进展。在SBT向LGSC转变过程中,与肿瘤增殖和EMT相关的蛋白表达发生变化。这些表达变化伴随着ECM重塑蛋白的显著变化,表明了密集的肿瘤微环境。LGSC-PT中细胞动态相关的生物学过程上调,与ephrin信号通路相关。基质从非侵袭性到侵袭性肿瘤阶段的过渡伴随着葡萄糖代谢的增加,以及NNMT等蛋白的上调,这些蛋白在侵袭性LGSC中高表达。
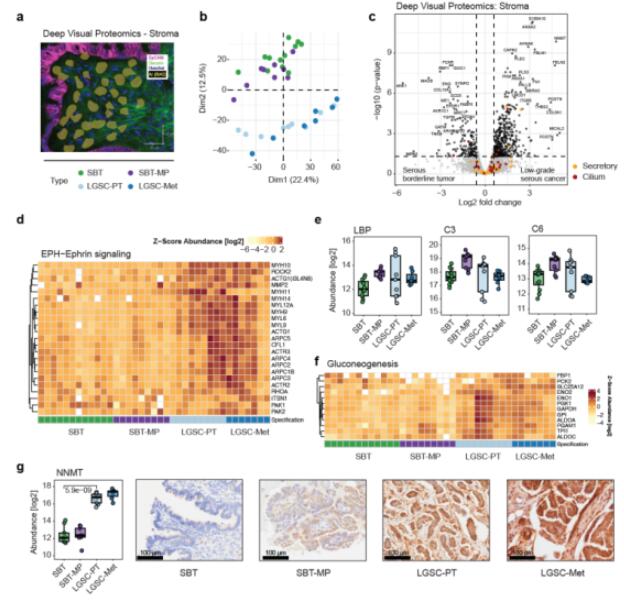
Fig.2 肿瘤基质区的空间蛋白质组分析揭示SBT向LGSC转变的双向性
3. SBT向侵袭性LGSC进展过程中空间转录组的特征变化
蛋白质表达最能反映细胞的功能表型,然而,将蛋白质与转录组变化联系起来能更好地理解LGSC的生物学特征,提供肿瘤细胞和周围基质细胞的通讯信息,识别只用一种组学分析手段可能错过的治疗靶点。使用GeoMx DSP技术,对ROI的转录组进行检测。在上皮中,发现1,386个转录本在SBT和LGSC-PT之间有差异表达。在SBT中,AGR2和MUC5B等基因上调,而在LGSC中则上调了CA-125结合伙伴MSLN和丝氨酸蛋白酶KLK6等基因。有趣的是,在LGSC-PT中,几个在神经系统中高表达的基因转录本,如SPOCK2和SNCG被上调。在蛋白质组学数据中,发现在SBT到SBT-MP的早期转变过程中,SNCG蛋白上调。GSEA分析发现粘蛋白编码基因表达水平、组织迁移、信号素通路和对EGF的应答发生变化。RTK受体c-Met及其下游效应子在LGSC和LGSC-Met中显著增加,与空间蛋白质组学结果一致。PCA分析表明上皮中SBT和SBT-MP的差异,基质基因表达明显区分了SBT/SBT-MP和LGSC-PT/LGSC-Met。已知的基质转录本,如S100A10、C3和NNMT,与空间蛋白质组学结果相一致。在CAFs中,上调的通路包括的基因与血管生成和缺氧有关。
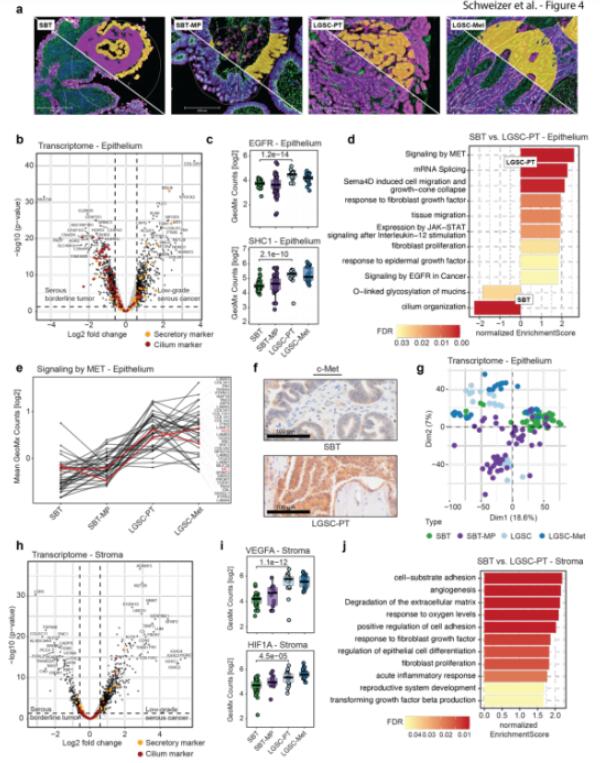
Fig.3 SBT和LGSC的空间转录组结果
4. 整合空间转录组和空间蛋白质组
整合空间蛋白质组、空间转录组和HE染色结果,可能在理解肿瘤器官时相互补充。特别是,蛋白质和转录本表达的整合能够揭示转录和翻译之间复杂的相互作用。在上皮和基质中,DVP和DSP之间有部分重叠的蛋白质和转录本,但差异表达的蛋白质和转录本重叠很少。这些结果表明两种技术可检测到的基因产物和生物调控方面的差异。因此,研究者将两种技术均定量检测到的基因用于下游分析,分别从上皮和基质中选择了两种技术检测到的最相关的蛋白质/转录本,并从下调表达结果中筛选出70个存在于肿瘤抑制因子数据库的靶点基因,结合文献综述注释其生物学相关性。这其中多个蛋白质都是临床批准或临床前抑制剂的靶点,如CCN2、ANXA2、ADAM15等。
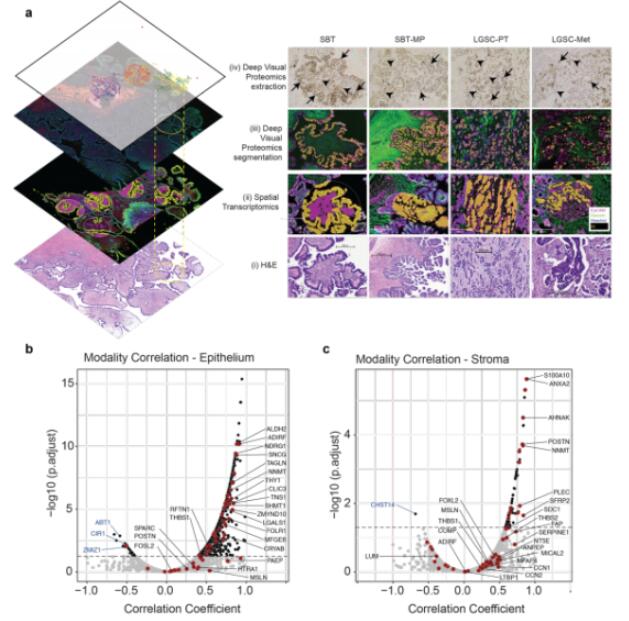
Fig.4 整合空间蛋白质组和空间转录组
5. 验证实验表征SBT向LGSC的转变过程
在描绘了从SBT到LGSC-met转变的蛋白质组和转录组图谱后,对几种LGSC细胞系进行质谱检测,并将其与空间蛋白质组学获取的上皮区域数据进行相关性分析,发现这些细胞系与SBT和LGSC-PT上皮中的蛋白质组学结果呈正相关。使用 VOA4627 LGSC 细胞系进行 siRNA 筛选,揭示了ADAM15、CLIC3、NOVA2、POSTN和SNCG等基因对细胞迁移的关键作用。对FDA批准的抑制剂进行测试显示,c-MET、EGFR和CDK抑制剂抑制了LGSC细胞系的增殖和侵袭,而FOLR1-抗体药物结合物仅抑制了细胞增殖。NNMT在LGSC中是最显著上调的基质驱动因子,在体内模型中,NNMT抑制剂减缓了LGSC细胞的皮下肿瘤生长。总体而言,从空间蛋白质组学和转录组学结果中预测关键通路和靶点,并使用FDA批准的抑制剂进行功能验证的思路,在研究LGSC进展时有关键作用。
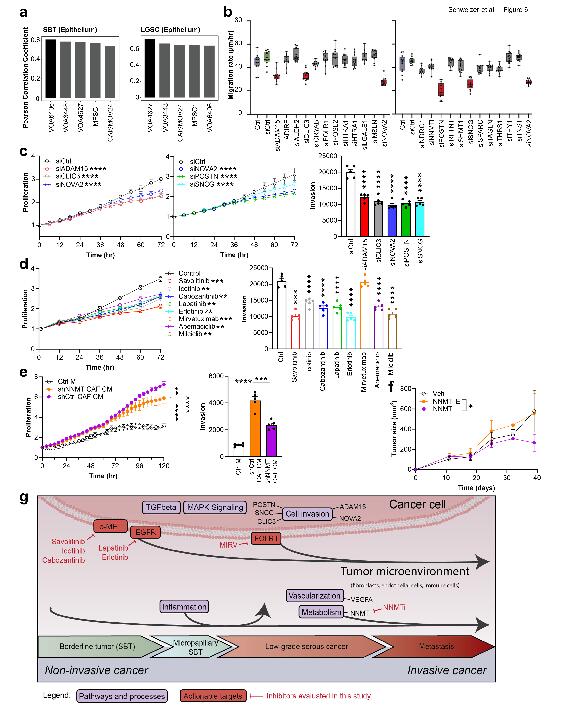
Fig.5 SBT向LGSC转变过程中重要的“组学”基因和通路的功能研究
主要结论
本研究利用空间蛋白质组和空间转录组技术阐明从SBT到LGSC及癌转移的演变过程中肿瘤和基质分子水平的变化特征。从SBT到LGSC的过渡发生在上皮组织中,经过具有微小乳头特征的中间阶段(SBT-MP),其中涉及MAPK信号逐渐增加。一组独特的蛋白质和转录本与向侵袭性肿瘤生长的过渡相关,包括在LGSC及其相应的转移中表达的神经剪接因子NOVA2。通路分析揭示了肿瘤细胞的异常分子信号传导,受到肿瘤微环境中血管生成和炎症变化的支持。随后通过敲除改变最大的基因或对最相关的靶点进行药物抑制,证实了它们在调控侵袭性的关键特征方面的功能重要性。结合细胞类型分辨的空间蛋白质组学和转录组学,使我们能够阐明从SBT到LGSC的肿瘤发生序列。这里提出的方法是系统阐明肿瘤发生机制和发现新治疗策略的蓝图。
参考文献:
Schweizer, Lisa et al. “Spatial proteo-transcriptomic profiling reveals the molecular landscape of borderline ovarian tumors and their invasive progression.” medRxiv 2023.11.13.23298409.





