深度解析ADC抗体偶联药物并有临床前研究模型介绍
2023年第114届AACR与4月14日至19日在奥兰多举行。在本次AACR中,涉及到ADC药物的相关信息多达470条。国内外药企持续发力,在会议上展现了ADC药物领域的诸多进展。作为创新药时下最火热的赛道,ADC药物究竟有何魅力?快跟随小编的脚步一起探索吧。
ADC药物全称为抗体偶联药物(Antibody-drug conjugate, ADC),是将抗体通过偶联臂(Linker)与小分子药物(Payload)共价连接的复合物。其关键组成有三部分:单克隆抗体、Linker、Payload
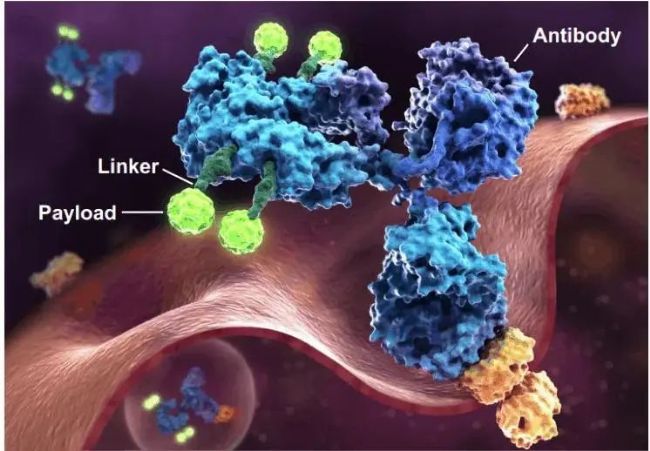
图1.ADC药物示意图(图片源于ADCREVIEW)
抗体
ADC药物利用抗体靶点特异性高、半衰期长等特点使其被作为药物运送载体。理论上来说,通过单克隆抗体的靶向性,ADC可以精准找到病灶,实现真正的“对症下药”。因此,抗体靶点的选择十分重要。靶向抗原应在肿瘤组织中高表达,但不能在正常组织中低水平表达或表达。目前热门靶点有CD 家族(CD33、CD30、 CD22、 CD79β、CD19)、HER2、Nectin-4、TROP2、BCMA、EGFR等。
ADC的抗体可以是单克隆抗体(单抗/mAb)或双特异性抗体(双抗/BsAb)。ADC的理想单抗应具有高靶标特异性、高靶标结合亲和力。此外,它应具有低免疫原性、低交叉反应性、高效内化和长血浆半衰期等特性。目前,ADC单抗主要使用IgG1亚型,因为IgG1血清稳定性高,对Fc受体的结合亲和力强。
相较于单抗,双抗ADC可以针对两个靶点,提高药物的打击范围;也可以针对同一靶点的不同表位,提高药物的整体内化效率。
Linker
Linker的设计在ADC的药代动力学和药效学特性中起着至关重要的作用。Linker必须保证ADC在血液循环中的稳定性,使其能够完整地到达癌细胞,但在内化时必须容易裂解,以便释放有效载荷。从广义上讲,Linker可分为两类:可裂解或不可裂解Linker。
可裂解Linker依赖于细胞中的生理条件来切割Linker,并可以进一步细分为酸敏感、蛋白酶敏感或谷胱甘肽敏感Linker。不可裂解Linker与mAb的氨基酸残基形成不可还原的键,因此在血液中应该更稳定,半衰期更长,脱靶毒性更低。不可裂解Linker需要ADC被溶酶体裂解后才能释放payload。
Payload
ADC中使用的payload一般是细胞毒性化合物。除细胞毒性外,血浆稳定性、低免疫原性、小分子量和长半衰期也是ADC有效payload的理想表征。目前最常用的payload主要针对DNA或微管蛋白,针对DNA的有:卡利霉素、双卡霉素、PBD、SN-38和DXd,针对微管蛋白的有 Auristatins(MMAE、MMAF) 和美登素衍生物(DM2,DM4)。
ADC主要作用机制
目前,ADC药物的适应症主要集中在血液瘤和实体瘤。由于其口服生物利用度差,ADC一般采用静脉注射的方式给药,其主要作用机制如下:
ADC主要作用机制:
1. ADC由静脉注射进入体内后,通过血液和淋巴系统进行转运。单克隆抗体通过识别细胞表面靶点特异性结合靶细胞。
2. ADC-抗原复合物通过clathrin或caveolin蛋白介导的内吞作用进入细胞,并被包裹在endosome中。早期endosome在与lysosome融合之前成熟为晚期endosome。对于具有可裂解linker的ADC,其裂解(如水解、蛋白酶裂解或还原性裂解)发生在早期或晚期endosome中。
3. Endosome与lysosome融合后,ADC由组织蛋白酶B和纤溶酶进行复杂的蛋白酶彻底降解。
4. Payload由溶酶体释放到细胞质中,通过DNA插入和抑制微管合成等方式诱导细胞凋亡。
5. 靶细胞凋亡。并且当目标细胞死亡后,活跃的payload也可能杀死周围的肿瘤细胞。
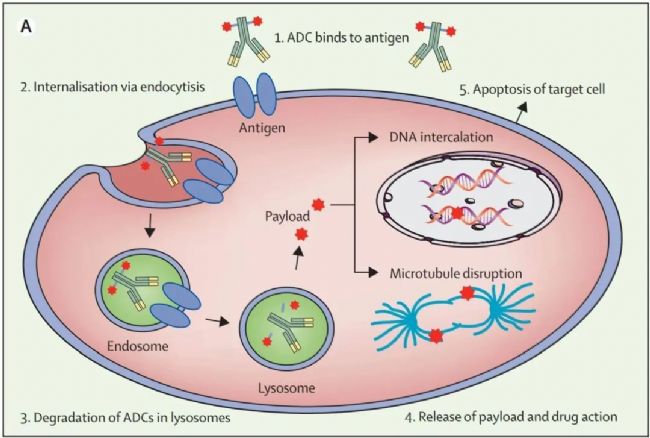
图2.ADC主要作用机制[1]
ADC其他作用机制
ADC的作用机制是多方面的。除细胞毒性payload直接诱导癌细胞死亡外,其他机制也被认为是其活性的一部分,如抗体介导的受体信号阻断、杀死邻近的抗原阴性癌细胞(即旁观者效应)、以及参与免疫效应细胞引起的抗肿瘤免疫等。具体机制如下:
ADC其他作用机制:
1. ADC和细胞表面表达的抗原的相互作用导致ADC的内化,随后释放细胞性载荷最终导致细胞死亡。
2. 在这个过程中,损伤相关分子模式(DAMPs)在肿瘤微环境中释放,并被未成熟的树突状细胞(DCs)通过Toll样受体 (TLR)识别。这一相互作用和payload的直接刺激促进了DCs的成熟。
3. 成熟的DCs迁移至淋巴结中激活naive T细胞。
4. 因此,激活的T细胞可以渗入肿瘤部位,识别并攻击癌细胞。
5. 在这一点上,若联合加入免疫检查点抑制剂(ICI)就可以增强T细胞针对肿瘤细胞的免疫反应。
6. 此外,ADC能够通过抗体依赖性细胞毒性(ADCC)、抗体依赖性细胞吞噬作用(ADCP)和/或补体依赖性细胞毒性(CDC)来激活免疫系统,达到抑制肿瘤的效果。
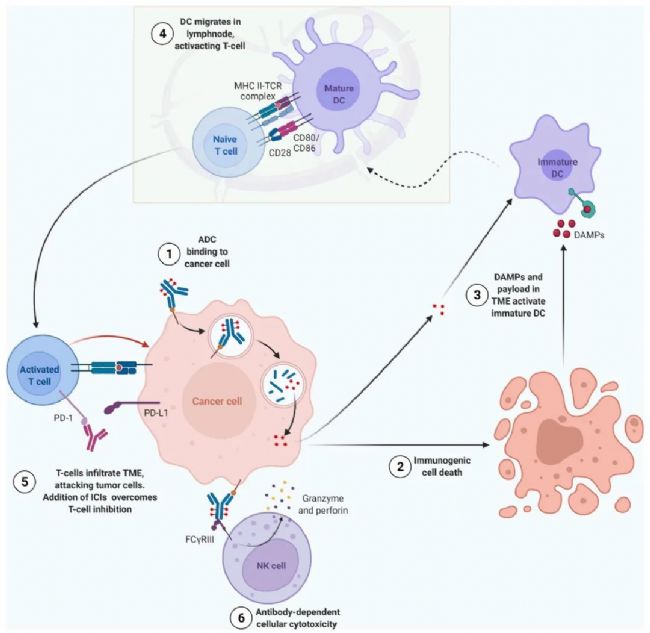
图3.ADC其他作用机制[2]
/ ADC联合免疫疗法 /
ADC与免疫细胞的相互作用,为ADC和免疫疗法的联合治疗开发提供了有力的依据。目前,我们可以针对以下三个方面开展免疫疗法的联合治疗:
Fc介导的效应器功能
在ADC的单克隆抗体中,Fab区介导目标抗原识别并决定抗体的特异性;而Fc区可以介导ADCC、ADCP、CDC。前两项取决于Fc与在NK细胞、巨噬细胞和其他免疫效应细胞表达的FcɣR的相互作用,而CDC由补体C1q介导。
在临床前模型中,T-DXd和T-DM1已证明会诱导与曲妥珠单抗同型相关的ADCC。因此,我们可以利用这一现象对ADC的设计进行调整。当抗体靶点是免疫细胞表面的蛋白时,尽量减少Fc介导的效应器功能,例如通过构建Fc区沉默突变体减少FCɣR的结合。而当靶点在癌细胞上表达时,情况则相反。我们可以使用afucosylated IgGs作为ADC的抗体,通过增加对FcɣRIIα的结合亲和力来增强ADCC。
另一种利用Fc-FcɣR相互作用的机制涉及肿瘤微环境(TME),特别是肿瘤相关巨噬细胞(TAMs)。临床前模型表明,非靶向ADC可以通过Fc-FcɣR相互作用而被TAMs内化,在TME内释放payload,从而对肿瘤细胞进行旁观杀伤。这一机制可能有助于ADC对异质性或低目标抗原表达的肿瘤的活性。然而,这种与目标无关的吸收机制可能会增加药物毒性,降低疗效。并且与TME中释放的payload可能杀死TME中的T细胞,损害免疫疗法的疗效。
免疫原性细胞死亡
肿瘤细胞受到外界刺激发生死亡的同时,由非免疫原性转变为免疫原性而介导机体产生抗肿瘤免疫应答的过程称为免疫原性细胞死亡(ICD)。
ICD是应激的垂死细胞诱导损伤相关分子模式(DAMP)易位的过程。DAMP主要包括暴露在肿瘤细胞表面的钙调蛋白(CRT)、HSP70/90,被肿瘤细胞释放的HMGB1、CXCL10和ATP,由肿瘤和/或免疫细胞产生的IFN-1。DAMPs可以激活CD8树突状细胞(DCs),最终激活先天和适应性免疫反应。
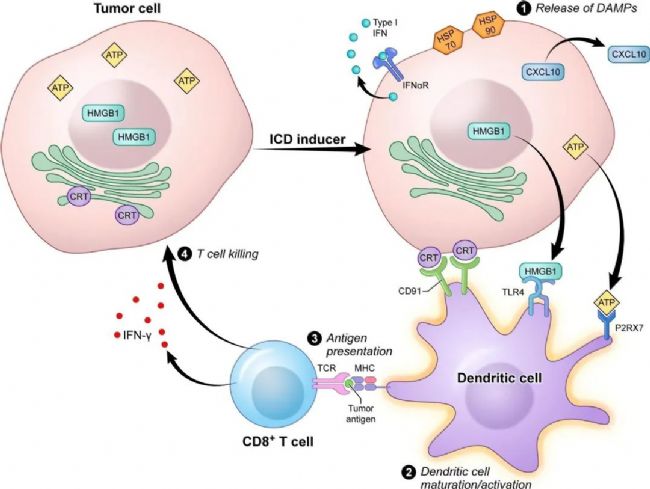
图4.免疫原性细胞死亡[3]
在小鼠模型中,以PBD和tubulysin作为payload的ADCs可以诱导ICD、免疫调节和免疫记忆。并且与免疫缺陷小鼠相比,这些ADCs在免疫能力强的小鼠中具有更大的抗肿瘤活性。例如,T-PNU(一种新型靶向HER2的ADC)在对其他靶向HER2疗法抵抗的乳腺癌模型中表现出非常高效的抗肿瘤活性。研究发现,它可以诱导ICD,并且其疗效因CD8 T细胞的耗竭而严重下降,证实了适应性免疫系统在调节T-PNU介导的抗癌活性中起到关键作用。T-PNU与抗PD-1疗法相结合也显着增强了治疗后的肿瘤根除。此外,T-PNU促进了肿瘤动物的免疫记忆形成,保护它们免受肿瘤的再次侵袭。
DC细胞的激活和成熟
成熟的DC细胞在癌症免疫中起着关键作用。它可以通过MHC II类复合物刺激抗肿瘤T细胞反应。肿瘤细胞可能通过抑制DC的成熟或诱导功能失调,诱发免疫抑制作用。
目前研究发现,常用作ADC payload的抗微管细胞毒素和拓扑异构酶I抑制剂都可以诱导DC激活和成熟。并且,相关ADC药物在免疫缺陷小鼠中的抗肿瘤效果明显降低。例如,T-DXd(一种靶向HER2的ADC)被证实在给药过程中增加了肿瘤浸润性DCs,并上调了DC细胞成熟和激活标志物的表达,增加了肿瘤浸润性CD8+ T细胞,并增强了肿瘤细胞上PD-L1和MHCI类的表达。在小鼠模型中,T-DXd与抗PD1的组合比单独给药的肿瘤抑制效果更强。
已上市ADC药物
目前已经有15款ADC药物获FDA批准上市,中国也已经批准了7款ADC药物。2021年6月8日,荣昌生物的维迪西妥单抗获批,成为第一个上市的国产ADC药物。
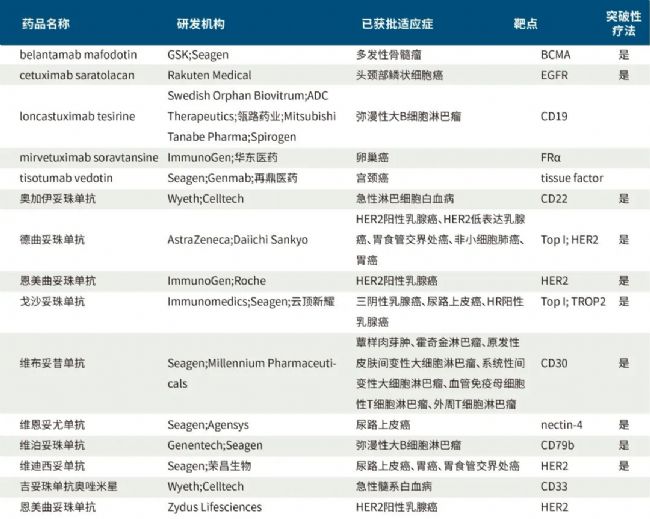
据不完全统计,截至2023年4月25号的整理数据如下表
(数据来源于医药魔方)
ADC药物临床前研究模型
为助力抗癌症药物开发,优化癌症治疗方案,南模生物针对ADC药物开发了一系列临床前研究动物模型,包括各类癌种的CDX/PDX模型;同时也针对ADC药物联合免疫治疗的临床前研究开发了一系列药物靶点人源化的同系移植瘤模型(这类模型具有健全的免疫系统,已成为ADC药物联合肿瘤免疫治疗评价的绝佳模型),具体信息见下表。
可移植的靶点人源化细胞系
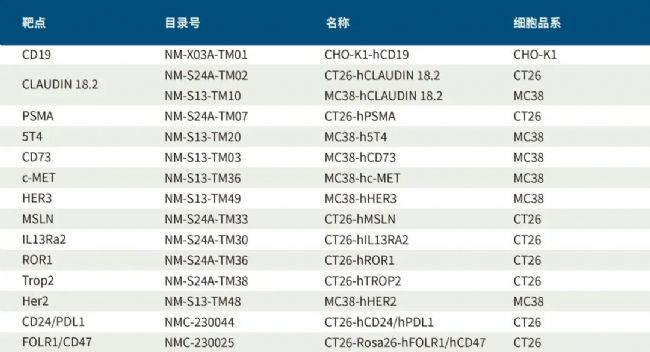
靶点人源化小鼠模型

ADC联合免疫治疗案例
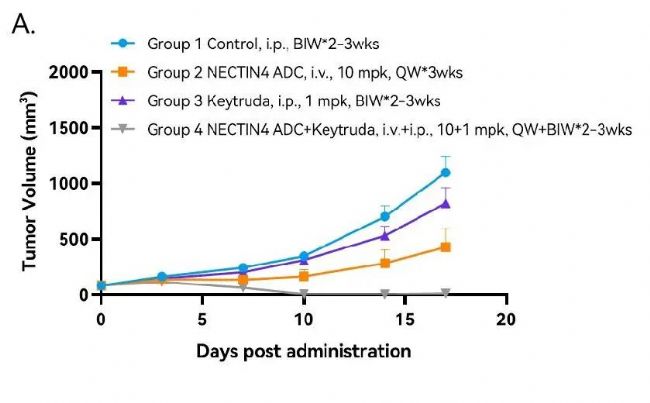
靶向NECTIN4 ADC药物药效评价模型
在C57BL/6背景的hPD-1小鼠上接种南模生物自主研发的MC38-hNectin4细胞系,构建同系移植瘤模型,用于靶向NECTIN4 ADC药物的药效评价。
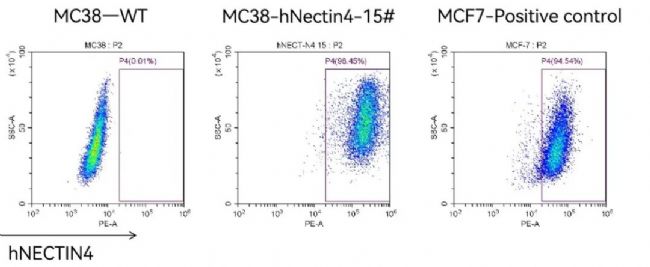
图5.流式检测MC38-hNectin4人源化细系中人源 NECTIN4的表达
Reference
[1] Chau CH, Steeg PS, Figg WD. Antibody-drug conjugates for cancer. Lancet. 2019;394(10200):793-804. doi:10.1016/S0140-6736(19)31774-X
[2] Nicolò E, Giugliano F, Ascione L, et al. Combining antibody-drug conjugates with immunotherapy in solid tumors: current landscape and future perspectives. Cancer Treat Rev. 2022;106:102395. doi:10.1016/j.ctrv.2022.102395
[3] Park SJ, Ye W, Xiao R, et al. Cisplatin and oxaliplatin induce similar immunogenic changes in preclinical models of head and neck cancer. Oral Oncol. 2019;95:127-135. doi:10.1016/j.oraloncology.2019.06.016





