多重免疫荧光/多重免疫组化及肿瘤微环境系列2:
蛋白质水平的多重免疫组织化学(mIHC)和多重免疫荧光(mIF)能分析、量化肿瘤中免疫细胞亚群、其功能状态及其在肿瘤微环境中的空间排列等,是目前检测肿瘤微环境免疫状态的核心技术。在准备开展mIHC/mIHC时样本数量、多通道成像、预算和是否有图像分析能力是重点考虑的事情。由于所有多重免疫组化(mIHC/mIF)都有创建和验证多种抗体组合的过程,我们南京泰立瑞的建议基本上都是关于创建一个由10-60个抗体组成的多重免疫组化检测模块的。我们提供了一个基于多重mIHC/mIF的初级介绍,整理了关键资料,并概述了计划和执行此类实验的主要考虑因素,主要受众是基础或转化医疗研发人员,或准备开展mIHC/mIF常规检测前建立方法学的临床病理、检验人员。
本篇是mIHC/mIF系列的第二篇,主要介绍开展mIHC/mIF的注意事项,将分别从组织处理、成本、生物标志物的选择三个方面展开。图一总结了宏观上主要应该考虑的事情,图二总结了需要考虑的主要技术因素。
图一:开展多重免疫组化(mIHC/mIF)需要考虑的主要因素
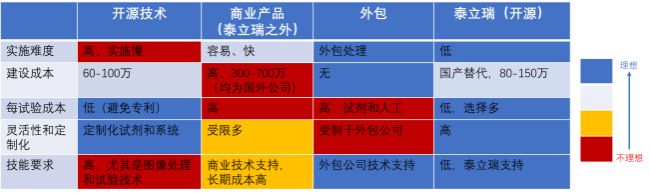
新鲜冷冻(FF)和福尔马林固定石蜡包埋(FFPE)样本均适用于多重免疫组化(mIHC/mIF)。开展多重免疫组化(mIHC/mIF)的样品制备方法时,应考虑保存组织结构、长期储存条件、抗原可及性和易于进行组织成像。FFPE标本处理法比大多数FF方法更好地保留了整体组织结构和细胞形态。实践中,为方便室温保存,大多数临床组织以FFPE块的形式保存,但FFPE法使许多目标抗原无法充分暴露,常常需要抗原修复。此外,福尔马林固定也增加自体荧光。特别要注意的是,与单一标记物IF/IHC相比,适用于一个抗原修复的条件可能不适用另一个抗原修复,使得多重免疫组化(mIHC/mIF)的开发颇具挑战性。相反,FF组织不需要抗原修复,但需要立即快速冷冻和超低温储存(<-80°C),以实现最佳组织保存。好消息是,使用1%多聚甲醛和去污剂法已被证明能够很好地保存组织结构,还能通过溶解红细胞使组织荧光最小化,并且能够在人类和小鼠组织中无需使用抗原修复,大多数抗体就可以直接进行免疫染色。
成本
在规划开展多重免疫组化(mIHC/mIF)业务时,一个常常大家被忽视的因素是总体成本和花费的时间,主要花费到包括试剂、抗体、培训、抗体组合优化、图像采集和数据分析上(图三)。评价花费是否合理的重要一点是每单位数据的成本(例如每个抗体染色的成本)和从多重染色中产生新发现的能力。往往一个单项IHC/IF实验可能花费数百元,而一个50种抗体组合的多重检测模块可能需要数千元。导致多重检测的时间和成本大幅增加的因素包括多重检测的复杂性(抗体数量、样本类型、样品制备步骤等)、多个检测循环时目标抗原的稳定性、在统一免疫标记条件下抗体兼容性和性能,以及检测循环中抗体组合和先后顺序的设计、调整,只有在上面提到的因素都进行最优化处理,才能获得最佳结果。
图二:开展多重免疫组化(mIHC/mIF)需要考虑的主要技术因素

生物标志物的选择
下游的分析是至关重要的:例如图像定标(例如DAPI或Hoechst 33342核染色图像定标),鲁棒性的细胞分割(例如核和膜染色分割)和无监督聚类(例如基于多种生物标志物组合染色的细胞表型分型)。梳理要囊括进一个mIHC/mIF检测模块中的生物标志物时,建议将生物标志物按“必须有”或“最好有”进行排序和分类,从而大大加快整个多重mIHC/mIF的开发。这些信息,连同预算和大致开发进度表,将决定一个多重mIHC/mIF检测模块要包括的生物标志物的数量。生物标记物的选择可以参考专家意见、现有文献、正交数据集和/或在线资源。搞定生物标志物目标清单之后,下一步就是评估和购买合适的抗体。近年来,产生了多个抗体数据库和搜索引擎(见系列4表),提供直观的用户界面。除了能发现高引用的抗体克隆外,这些平台还允许研究人员查询许多相关领域,如组织和细胞类型、应用、公司和宿主物种,同时通常提供参考染色图像。从这些资源开始往往是一个很好的开端,帮我们找到在传统单IHC染色中显示鲁棒性的试剂。然而,这些数据库往往没有与多重mIHC/mIF检测相关的性能细节,例如抗原稳定性、抗原抗体结合位点的空间位阻以及与其他抗体的兼容性。出于这些原因,我们可以提供了一份先前成功使用FF、或FFPE制备的小鼠和人体组织进行多重免疫组化mIHC/mIF染色并得到验证的抗体列表,作为创建自定义检测模块的起点(需要请联系南京泰立瑞信息)。对希望常规开展mIHC /mIF的实验室,我们建议以已知或已验证的抗体或抗体模块及其使用先后顺序为基础,创建基础抗体模块,再通过添加感兴趣抗体到基础抗体模块中,形成新的模块,解决和回答新问题,这种方法减少了创建一个mIHC/mIF时抗体验证相关的时间和资金。此外,具有质量控制措施的重组单克隆或多克隆抗体提供了最少的批间变异,使其更适合于高度复合的抗体模块开发。还应该优先使用有严格质控的杂交瘤衍生单克隆抗体,最后才考虑多克隆抗体。对每个供应商的每个批次都要进行基于特定应用和特定样本的测试,以确保实验重现性。
图三:多重免疫组化(mIHC/mIF)开发的流程和4阶段全过程
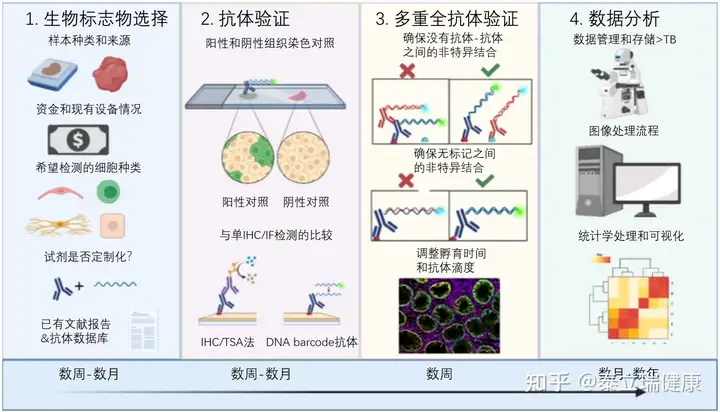
此外,找到和采购抗体可能需要几天-几周时间,并且可能还需要直接使用标记的一抗。开发一个新型多重免疫组化(mIHC/mIF)检测,往往可能需要数周甚至数月的时间,因为多重检测种使用的每个抗体都需要首先在单IHC/IF实验中得到验证,然后在整个多重检测种进行性能评估。并非在单IHC/IF实验中成功工作的抗体都能在多重免疫组化技术中工作,而且每个多重免疫组化都需要样本特异性抗体滴定。基于金属离子的平台往往一次性投入更多,因为需要专门的成像仪器和昂贵的标记试剂。除了试剂外,不同的技术平台对培训的要求也大不相同,某些平台可能会大幅增加成本。基于荧光的方法比基于质谱的方法花费在多重检测阶段的开发时间更长,因为这些方法往往都有染色-照相-洗脱循环。然而,所有的技术平台随着其商业化的进展,时间、培训和优化成本将逐步降低。
目前基于荧光标记的多重荧光组织免疫mIF/mIHC是探测肿瘤微环境应用最广泛的技术,TLR专注于mIF/mIHC的相关技术,致力于将免疫染色(mIF/mIHC)、荧光图像采集和分析的自动化和智能化,研发用于mIF/mIHC的全自动免疫组化染色机(TR-Stainer)和荧光全切片扫描仪,其中TR-sWSI-5F荧光扫描仪是一款轻量入门级产品,具备快速5色扫描功能(蓝色DAPI、绿色FITC、黄色TRITC、红色Cy5、近红外Cy7),满足目前免疫荧光组化的绝大多数临床需求。而TR-sWSI-MF 的多光谱荧光扫描仪可以将多达15种颜色和自体荧光彼此得到很好的分离,从而使用户信心百倍地专注于量化真正发生的生物学相互作用,能够在整个切片上同时观察和测量组织的细胞,包括多种细胞表型。





