肿瘤免疫治疗的下一个
免疫力是人体自身的防御机制,是战胜病毒的终极武器。免疫力的强弱与机体的免疫细胞息息相关。而NK细胞是固有免疫细胞家族中的重要成员,常年奋战在人体抵抗癌细胞和病毒感染的第一道防线上,是守卫人体健康的生力军。有科学研究表明:自然杀伤细胞(natural killer cells ,NK细胞)数量充足且活性更好的患者,病毒载量下降更快,症状或更轻!
本文将围绕NK细胞的发育和分类、NK细胞的激活和抑制信号、肿瘤微环境中的NK细胞、NK细胞相关免疫治疗等方面展开,带大家认识一下NK细胞~
1 NK细胞的发育和分类
目前主流的NK细胞发育模型认为,NK细胞来源于骨髓中的CD34+CD45RA+造血祖细胞(HPCs)。在骨髓中,NK细胞由HPCs通过常见的淋巴样祖细胞(CLPs)和NK细胞前体(NKPs)发展而来,然后迁移到外周血(Conventional NK cells, cNK细胞)或组织(tissue-resident NK cells, trNK细胞)。
trNK细胞的分化发生在不同的组织部位,包括肺、胸腺、肝脏、子宫、皮肤、皮下脂肪组织和肾脏。在这些位点,NK细胞具有不同的表型特征和功能,构成了NK细胞在不同成熟阶段的循环。除了不同的组织类型外,即使在同一器官和同一组织中,NK细胞也具有高度的异质性。

图1. NK细胞的发育和亚群[1]
NK细胞通常根据表面蛋白CD56和CD16的相对表达分为两类:CD56brightCD16-(免疫调节,细胞因子产生)和CD56dimCD16+(细胞毒性)。其中,CD56dimCD16bright占全部NK细胞的90%,CD56brightCD16neg/dim只占约10%。
CD56bright NK细胞是强大的细胞因子生产者,除非被IL-15等促炎细胞因子启动,否则具有弱细胞毒性。相比之下,CD56dim NK细胞群可以介导感染和/或恶性细胞的系列杀伤,主要是通过含有颗粒酶B和穿孔素的预先组装的细胞溶解颗粒的胞吐作用,最终诱导靶细胞凋亡。

图2. NK细胞的表型及功能[2]
2 NK细胞的激活和抑制信号
NK细胞作为固有免疫的主要效应细胞类型,能够在早期杀伤肿瘤细胞和病毒感染细胞。它们依靠“迷失自己”(missing-self)和“诱导自己”(induced-self)模式来识别靶细胞,在激活信号和抑制信号之间保持精确的平衡。这些相互作用的信号最终决定了NK细胞的激活和功能状态。
NK细胞激活信号包括细胞因子结合受体、整合素、杀伤受体(CD16、NKp40、NKp30和NKp44)、识别非自身抗原的受体(Ly49H)和其他受体(如NKp80、SLAMs、CD18、CD2和TLR3/9)。总的来说,根据配体的不同,NK细胞的激活受体至少可以分为三种类型,包括MHC-I特异性受体、MHC-I相关受体和MHC-I非相关受体。
NK细胞抑制信号主要包括识别MHC-I的受体,如Ly49s、NKG2A和LLT1,以及一些MHC-I非相关受体。此外,MHC-I特异性抑制受体根据结构和功能一般可分为三种类型:杀伤细胞免疫球蛋白样受体(KIRs)、杀伤凝集素样受体(KLRs)和白细胞免疫球蛋白样受体(LILRs)。

图3. NK细胞功能受细胞表面受体和细胞因子的调节[3]
3 肿瘤微环境中的NK细胞
肿瘤微环境(tumour microenvironmentm, TEM)高度复杂且不断发展,其可维持肿瘤生长并影响免疫逃逸和恶性肿瘤进展,除了基质细胞、成纤维细胞和内皮细胞外,TME还包括固有免疫细胞和适应性免疫细胞。
NK细胞常见于人类肿瘤的TME,包括原发肿瘤、转移灶和肿瘤浸润淋巴结。当NK细胞被整合素、趋化因子受体和选择素招募时,它们从血液中渗出,穿过ECM和肿瘤间质,到达肿瘤床。在TME中,NK细胞通过脱颗粒、ADCC或 FASL/TRAIL诱导的凋亡消除肿瘤。此外,NK细胞还可以分泌细胞因子或趋化因子来招募其他免疫细胞,并上调其抗肿瘤反应。NK细胞的反应性往往受到肿瘤细胞或其他细胞分泌的抑制因子或细胞与细胞直接相互作用的阻碍。
临床统计数据表明,TME中NK细胞的丰度预示着几种癌症患者的预后更好,包括肝细胞癌(HCC)、黑色素瘤、乳腺癌、非小细胞肺癌(NSCLC)、鳞状细胞肺癌、肺腺癌、肾细胞癌、胃癌。这种浸润不仅增强了对靶细胞的直接杀伤,而且还提供了免疫调节细胞因子,从而形成适应性免疫反应。

图4. 肿瘤微环境中的NK细胞[4]
4 NK细胞相关免疫治疗
NK细胞能够识别并与肿瘤细胞反应,是一种重要的抗肿瘤免疫疗法效应器。
近年来,NK细胞相关免疫治疗的研究蓬勃发展,最新的进展主要集中在细胞因子疗法、过继性NK细胞疗法、基因工程化NK细胞疗法、单克隆抗体和NK细胞衔接器等方面。此外,基于NK细胞的治疗无论是单独使用还是与其他治疗方法联合使用都取得了良好的效果,这表明它在恶性肿瘤中具有广泛而有效的应用前景。

图5. 基于NK细胞的治疗策略[5]
1) 细胞因子疗法
据报道,IL-2可以直接刺激T细胞和NK细胞的增殖和激活。因此,IL-2经常被用于在体外激活NK细胞,然而它在体内的使用受到毒副作用和激活免疫抑制性调节性T细胞(Treg)的限制。为优化IL-2作为免疫治疗剂的疗效,研究人员对IL-2进行了修饰或工程化处理以诱导NK细胞的更大激活和扩张,同时减少Treg细胞的扩张。
IL-15是有望替代IL-2功能的细胞因子之一,它可以刺激NK和CD8+T细胞,但是不会激活Treg细胞。目前,多款IL-15重组蛋白正在临床试验中接受检验。此外,其他可用于激活NK细胞的细胞因子有IL-12、IL-18、IL-21,以及TGFβ抑制剂。
2) 过继性NK细胞治疗
大多数以NK为基础的过继转移治疗从各种来源获取NK细胞,通过各种方法增强其体外功能,然后将其注入癌症患者体内。自体和同种异体NK细胞都可以作为过继性NK细胞疗法的来源。
目前,同种异体的NK细胞来源多种多样,包括外周血NK细胞、来自脐带血或胎盘的NK细胞,以及从诱导多能干细胞(iPSC)分化生成的NK细胞。有些研究显示,脐带血来源的NK细胞更容易培养并且激活,不过从成人外周血中获得的NK细胞更具有天然的细胞裂解能力。NK细胞系(比如NK92)和iPSC细胞系可能提供可以重复再生的NK细胞来源。
3) 基因工程化NK细胞疗法
通过嵌合抗原受体(CARs)对免疫细胞进行基因修饰,直接靶向肿瘤细胞是一种很有前途的癌症治疗方法。在NK细胞表面表达靶向肿瘤抗原的CAR可以赋予NK细胞靶向特定肿瘤的能力。
与CAR-T相比,CAR-NK治疗的优势很明显,包括识别肿瘤的可能性更高(包括细胞因子和凋亡),细胞因子释放风暴(cytokine releasing storm , CRS)的发生率更低。而且即使CAR-NK细胞失去了CAR,仍然可以通过内在表达的激活性受体识别和杀伤肿瘤细胞。
4) 单克隆抗体
根据抗体的靶向不同,可以分为两类:
一类是靶向肿瘤相关抗原的治疗性抗体,例如靶向表皮生长因子受体(Epidermal Growth Factor Receptor, EGFR)的西妥昔单抗(Cetuximab)、靶向CD20的利妥昔单抗(Rituximab),通过NK细胞诱导ADCC效应达到治疗目的;另一类是直接靶向NK细胞抑制受体的抗体,例如靶向NKG2A的莫那利珠单抗(Monalizumab),活化NK细胞对肿瘤细胞进行杀伤。
5) NK细胞衔接器
各种免疫逃避机制限制了NK细胞在体内与肿瘤细胞的结合程度,是实现广泛有效的NK细胞治疗的主要障碍。为了增强肿瘤浸润性NK细胞的自然细胞毒性,许多研究团队已经在开发一些分子,使这些细胞以抗原特异性的方式与肿瘤细胞接触。这些分子通常是由多个抗体(通常为单链抗体)组成的双特异或三特异性接合器,可以同时靶向肿瘤细胞抗原以及NK细胞活化受体,将NK细胞和肿瘤细胞“拉拢”在一起,进而引发NK细胞杀伤肿瘤细胞。
5 NK细胞研究相关小鼠模型
基于现有研究,南模生物自主研发了一系列NK细胞相关工具鼠,如Cre工具鼠,荧光报告工具鼠和DTR工具鼠等。Cre工具鼠跟特定的flox小鼠交配,可实现在NK细胞中敲除或者敲入目的基因,完成对基因在NK细胞中的功能研究;荧光报告工具鼠是通过在小鼠marker基因处敲入报告基因构建而成,可以达到在体内标记NK细胞的目的;DTR工具鼠则是在小鼠marker基因位点敲入DTR(diphtheria toxin receptor,白喉毒素受体),可以用于研究巨噬细胞在免疫系统中的作用;NVG-hIL15小鼠模型是对M-NSG小鼠Il15基因进行人源化修饰构建而成,在进行免疫系统重建时,可以得到更高比例的NK细胞,用于CAR-NK细胞治疗等方面的药效研究。
此外,南模生物还可提供NK细胞相关靶点人源化的小鼠模型,为NK相关药物的药效评估和安全性评价提供了强有力的工具。具体信息见下表:

验证数据:
· Ncr1-2A-Cre(NM-KI-190027)

图6. 流式检测Ncr1-(2A-iCre)+/-; Rosa26 tdTomato+/- 小鼠外周血和脾脏的NK细胞中tdtomato的表达。

图7. Ncr1icre/+; Rosa26tdTomato/+ 双转基因鼠,可在皮肤、肾脏、颌下唾液腺(SMG)和脑的部分细胞中表达tdTomato。
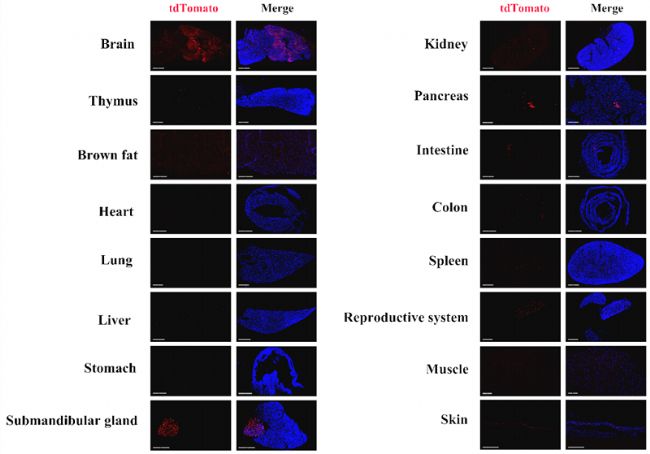
图8. Ncr1icre/+; Rosa26tdTomato/+ 小鼠各组织中tdTomato的表达情况。
· Ncr1-IRES-DTRGFP(NM-KI-190044)

图9.Ncr1-IRES-DTRGFP 杂合子MC38荷瘤小鼠和野生型MC38荷瘤小鼠不同时间点肿瘤生长情况。(数据是与CrownBio 合作完成)

图10. Ncr1-IRES-DTRGFP杂合子MC38荷瘤小鼠和野生型MC38荷瘤小鼠不同时间点外周血中NK 细胞含量。(数据是与CrownBio 合作完成)

图11. Ncr1-IRES-DTRGFP杂合子MC38荷瘤小鼠和野生型MC38荷瘤小鼠不同时间点外周血中NK 细胞含量。(数据是与CrownBio 合作完成)
· NVG-hIL15(GM-NVG-210001)

图12. 人PBMC在NVG-hIL15中的移植效率和在体内对K562-luc细胞的生长抑制。

图13. 外周血来源NK细胞在NVG-hIL15小鼠中的增殖和细胞毒性。

图14. CAR-NK92细胞在NVG-hIL15小鼠体内对肿瘤细胞的杀伤毒性。
南模生物深耕基因编辑领域,提供全方位模式生物服务,包括基因修饰成品模型供应、个性化模型定制、饲养繁育、表型分析、药效评价等,满足不同实验室需求。
Reference:
[1]Wu SY, Fu T, Jiang YZ, Shao ZM. Natural killer cells in cancer biology and therapy. Mol Cancer. 2020;19(1):120. Published 2020 Aug 6. doi:10.1186/s12943-020-01238-x
[2]Heipertz EL, Zynda ER, Stav-Noraas TE, et al. Current Perspectives on "Off-The-Shelf" Allogeneic NK and CAR-NK Cell Therapies. Front Immunol. 2021;12:732135. Published 2021 Dec 1. doi:10.3389/fimmu.2021.732135
[3]Wolf NK, Kissiov DU, Raulet DH. Roles of natural killer cells in immunity to cancer, and applications to immunotherapy [published online ahead of print, 2022 May 30]. Nat Rev Immunol. 2022;10.1038/s41577-022-00732-1. doi:10.1038/s41577-022-00732-1
[4]Ran GH, Lin YQ, Tian L, et al. Natural killer cell homing and trafficking in tissues and tumors: from biology to application. Signal Transduct Target Ther. 2022;7(1):205. Published 2022 Jun 29. doi:10.1038/s41392-022-01058-z
[5]Crinier A, Narni-Mancinelli E, Ugolini S, Vivier E. SnapShot: Natural Killer Cells. Cell. 2020;180(6):1280-1280.e1. doi:10.1016/j.cell.2020.02.029
[6]Abel AM, Yang C, Thakar MS, Malarkannan S. Natural Killer Cells: Development, Maturation, and Clinical Utilization. Front Immunol. 2018;9:1869. Published 2018 Aug 13. doi:10.3389/fimmu.2018.01869
[7]Maskalenko NA, Zhigarev D, Campbell KS. Harnessing natural killer cells for cancer immunotherapy: dispatching the first responders. Nat Rev Drug Discov. 2022;21(8):559-577. doi:10.1038/s41573-022-00413-7
[8]曹雪涛.医学免疫学(第9版)[M].北京:人民卫生出版社,2018.





