DMD人源化小鼠模型在杜氏肌营养不良症基因治疗研究中的应用

有这样一种疾病,其发病患者通常是3-5岁的孩童,患者一开始会出现进行性肌无力症状,在12岁左右慢慢失去了行走能力,它就是杜氏肌营养不良症(Duchenne muscular dystrophy, DMD)。
近年来,在社会各方力量的持续关注和努力下,国内对DMD的社会认知度有了一定的提高,诊疗技术、药物研发也在不断向前推进着。据悉,Sarepta Therapeutics公司已向FDA提交了一份生物制品许可申请(BLA),SRP-9001有望成为第一款通过AAV治疗DMD的基因疗法;Cure Rare Disease也在今年取得新进展,其研发的CRD-TMH-001是首款获批进入DMD临床试验阶段的CRISPR基因编辑疗法。
01 关于DMD的临床表现
DMD是一种由编码肌营养不良蛋白的基因Dystrophin突变引起的罕见的致命性神经肌肉遗传病,全世界每3500-5000名男性中就有一人发生。DMD的症状通常出现在婴幼儿身上,患者可能会经历发育迟缓、站立困难等,然后逐渐丧失独立进行日常活动的能力,最终出现呼吸困难和心力衰竭。该病是普遍致命的,患者通常会死于20多岁。目前其发病机制尚未阐明,现有治疗只能减缓患者肌肉萎缩进程,延长3-5年行走能力,增强心肺功能。
02 DMD基因治疗的研究现状
DMD疾病发现于19世纪,也是如今大热的基因治疗领域中最受关注的疾病之一。这是由于该疾病的致病基因十分明确,该基因在保证人类正常肌肉结构和功能中是不可或缺的。作为一个超大基因,DMD长度超过2.2 M bp,这也导致了它潜在发生突变位点的数量大大增加。其突变类型以基因内缺失为主,且存在一段“突变热点”区域,即基因缺失的高发点为外显子45-55区,外显子2-19区则次之。
DMD的基因治疗方法主要有外显子跳跃和AAV补充mini基因,但因需要不断给药及研究模型的缺陷,基于CRISPR基因编辑的治疗手段作为一种破局新策略应运而生。有文献表明,CRISPR治疗可以在单个外显子人源化小鼠(Δ50;h51KI)及TG大片段点人源化疾病小鼠(hDMDΔ52/mdx)上起到治疗效果,前者删除了突变外显子51,后者能做到大片段的跳跃,适合50%以上患者。我们可以来了解下当前研发进程中3种具有代表性的药物:

03 人源化小鼠带来的研发新局面
随着模式动物和基因治疗的发展,基因治疗对模式动物提出了更高的要求,而人源化小鼠模型是提高临床前研究效率重要的一环。这里为大家列举一些DMD药物研发常用的小鼠模型以供参考:
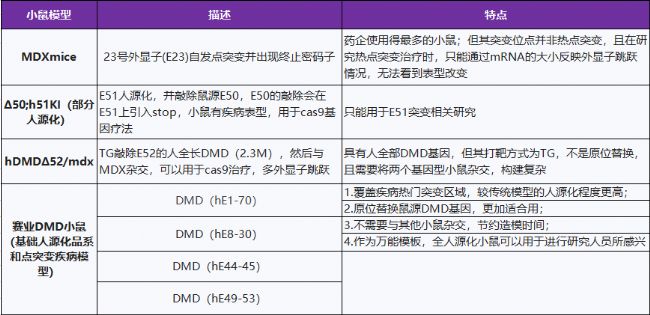
在诸多的研究方法中,MDX小鼠突变点并不是热点突变区,单个外显子人源化及TG模型也存在着明显不足。基于此种现状,赛业生物自主研发的TurboKnockout融合了BAC重组进行技术创新,在小鼠的基因上实现原位替换,人源化小鼠模型更加适合不同ASO、gRNA的筛选,可以在mRNA、蛋白质和功能水平上进行比较,并满足药代动力学和药效学等实验需求。
热点区域的部分人源化/突变疾病的小鼠模型
人源化区域可以覆盖基因治疗管线的热点区域,也可以用ASO和CRISPR疗法进行热点突变基因的单个及多个跳跃疗法。
DMD全人源化小鼠模型
赛业生物拥有超大片段打靶能力,DMD部分人源化小鼠模型已实现,针对DMD基因超过2.2M bp的长度,赛业正在布局DMD的全人源化模型,攻克基因组中已知最大的基因打靶难题,构建一款可以适用于所有点突变的致病机理及基因编辑治疗的临床前研究的动物模型。
此外,针对脊髓性肌萎缩、自主神经功能异常、视网膜色素变性等神经/眼科疾病,赛业生物开发了一系列基因敲除的小鼠模型和人源化小鼠模型,也可以根据你的研究需求实现个性化定制。我们诚邀神经/眼科相关的研究人员们共同探讨,赛业生物期待与你一同为患者的康复之路奉献力量。
Part 1 神经
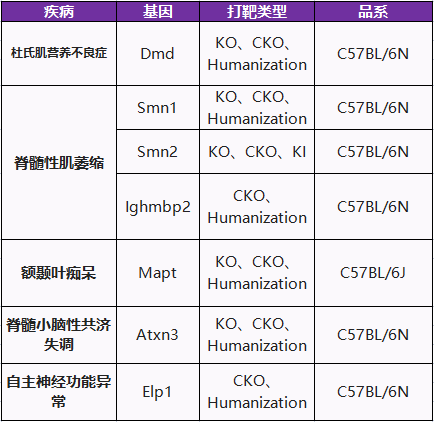
Part 2 眼科

人源化小鼠如何构建?
人源化小鼠有哪些应用方向?
人源化小鼠如何助力遗传病基因治疗研究?
到我们为你精心准备的2份实用指南里寻找答案吧,扫码即可免费下载「人源化小鼠模型的构建和应用」和「人源化小鼠模型助力遗传病基因治疗研究」电子版。

- Mendell J R, Sahenk Z, Lehman K, et al. Assessment of systemic delivery of rAAVrh74. MHCK7. micro-dystrophin in children with Duchenne muscular dystrophy: a nonrandomized controlled trial[J]. JAMA neurology, 2020, 77(9): 1122-1131.
- Wells D J, Wells K E, Asante E A, et al. Expression of human full-length and minidystrophin in transgenic mdx mice: implications for gene therapy of Duchenne muscular dystrophy[J]. Human Molecular Genetics, 1995, 4(8): 1245-1250.
- Lee T, Awano H, Yagi M, et al. 2′-O-methyl RNA/ethylene-bridged nucleic acid chimera antisense oligonucleotides to induce dystrophin exon 45 skipping[J]. Genes, 2017, 8(2): 67.
- Deng J, Zhang J, Shi K, et al. Drug development progress in duchenne muscular dystrophy[J]. Frontiers in pharmacology, 2022, 13.
- Veltrop M, van Vliet L, Hulsker M, et al. A dystrophic Duchenne mouse model for testing human antisense oligonucleotides[J]. Neuromuscular Disorders, 2016, 26: S128-S129.
- Aoki Y, Nakamura A, Yokota T, et al. In-frame dystrophin following exon 51-skipping improves muscle pathology and function in the exon 52–deficient mdx mouse[J]. Molecular Therapy, 2010, 18(11): 1995-2005.
- Zhang Y, Li H, Nishiyama T, et al. A humanized knockin mouse model of Duchenne muscular dystrophy and its correction by CRISPR-Cas9 therapeutic gene editing[J]. Molecular Therapy-Nucleic Acids, 2022, 29: 525-537.





