单细胞核测序技术在抗抑郁药物治疗的时间反应研究中的应用
经常emo?抑郁症要数月治疗才可能有效果!
什么是emo?emo一词最初指代一种摇滚音乐类型“情绪硬核”(Emotional Hardcore),但在当今互联网语境中,它更多是作为 emotional的缩写,被用来指代平日中会时不时出现的情绪化时刻,无人理解的苦恼、加班到深夜的委屈、囊中羞涩的尴尬、一地鸡毛的生活琐事等,“我颓了”、“我抑郁了”、“我太难了”、“我网抑云了”、……即一切“心情不好”的瞬间。emo往往是一种现时情绪,很快就会消逝,并不会让人长时间沉浸其中。
而抑郁症则不同,既存在精神心理症状,同时也伴有一系列的生理不适。其发作往往会有持续两周以上的心情低落、思维迟缓、意志活动减退、认知功能损害,以及睡眠障碍、乏力、食欲减退等躯体不适症状。据估计,全球有3.5亿人患有抑郁症。而通常的处方抗抑郁药,如选择性血清素再摄取抑制剂(SSRIs)需要数周甚至数月才能达到治疗效果。为什么抗抑郁药物需要数周或数月才能逆转抑郁情绪,其潜在机制尚不清楚。
一篇发表在bioRxiv上题为“Neuron-Glia Signaling Regulates the Onset of the Antidepressant Response”的预印本文章,利用10x Genomics单细胞核测序技术,分析了应激性抑郁小鼠的基因表达变化,并确定了它们对大脑皮层抗抑郁药物治疗的时间反应,以及促进抗抑郁药物反应发生的细胞类型,从而为减轻抗抑郁药物治疗延迟发生提供新的研究思路。

选择性血清素再摄取抑制剂(SSRIs)由于其安全性、有效性和耐受性,已被用于治疗抑郁症的一线药物数十年,并被批准用于成人和儿童患者。SSRIs对三分之二的重度抑郁症(MDD)患者有效,用几周时间可以改善情绪。在这期间,患者会出现多种副作用,其中自杀意念是最主要的。对重度抑郁症患者的尸检和神经影像学分析发现,在抑郁症病理生理学过程中,关键神经元网络存在结构和功能障碍。已知在啮齿类动物模型中,抗抑郁药物能在治疗后数小时内提高细胞外血清素水平,并被认为能通过诱导长期的神经元适应来逆转结构和功能异常,如神经发生、神经元形态改变和突触可塑性。在人类和啮齿类动物模型中,则需要数周时间通过这些适应来改善情绪,这表明在反应开始时存在更广泛的、保守的血清素依赖机制,而这些机制尚不清楚。
不同类型的大脑皮层细胞对压力和抗抑郁药物治疗有反应
为了确定抗抑郁药物反应中导致数周延迟的机制,研究人员使用来自小鼠大脑皮层的单细胞核RNA测序(snRNAseq),利用10x Genomics平台分析了应激和抗抑郁治疗后基因表达变化的时间动态。大脑皮层是皮质边缘情绪回路的一个重要区域。小鼠被置于社会隔离的环境中,培养压力以诱发类似抑郁的行为,并用氟西汀(fluoxetine,一种广泛使用的选择性血清素再摄取抑制剂/SSRI)处理。在治疗早期(3天)、一周(7天)和接近观察到的行为改善(10天)时,分析不同组的基因表达变化。将12周龄小鼠大脑皮层解剖,每个时间点共采集24个样本,分为4个实验组:Control, ControlFlx, Stress和StressFlx,每个实验组6只动物。每个样本处理5000个细胞核。通过蔗糖偏好测试,压力大的动物表现出快感缺乏,当测量它们的声音惊吓反应时,它们的情绪状态显示出了更高的惊吓反应。为了确定基因表达的变化,研究者首先收集了所有时间点和治疗组的综合数据集。然后,研究人员根据在每个亚群中富集的相应标记基因来鉴定细胞群,并在现有数据库中回顾细胞类型特异性标记基因表达模式,确定了36个不同的亚群。研究者观察到,随着治疗的时间进程,应激影响的氟西汀规范化基因的转录调控稳步增加。值得注意的是,如治疗第3、7和10天的火山图所示,研究者发现应激诱导的变化正常化发生在胶质细胞、神经元和神经元间的细胞群中。

应激和氟西汀治疗后神经元和神经胶质细胞群的转录变化
接下来,研究者通过基因本体论(GO)分析,在个体胶质和神经元细胞群体水平上分析了应激影响氟西汀正常化基因的动态变化,发现在抗抑郁药物的早期反应中,神经胶质和神经元群体都参与了。少突胶质细胞前体(OPC)细胞在治疗第7天也有显著差异表达。最后,在治疗第10天,多个神经元群体、表达小清蛋白(PV)的中间神经元、星形胶质细胞和成熟少突胶质细胞的基因表达发生变化。成熟少突胶质细胞仅在治疗第10天发生变化。与多个神经元群体的改变同时发生。这些观察表明,神经胶质和神经元群体对氟西汀治疗有高度组织性的反应。
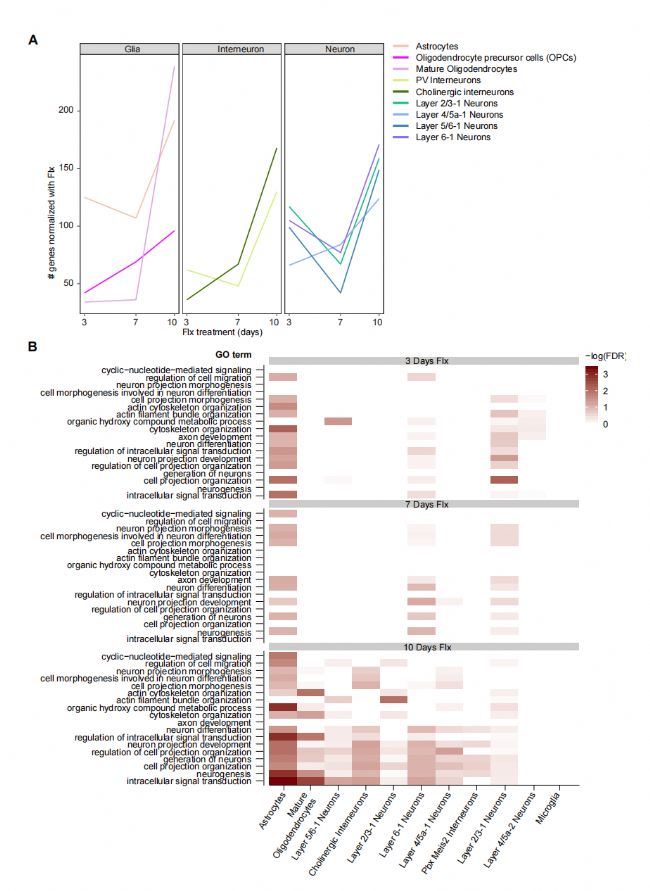
为了进一步描述细胞类型的特定功能,研究者确定了神经胶质和神经元群体中调节应激影响氟西汀调节基因的上游调节因子,并确定了群特异性的潜在调节因子,如TCF7L2、RxRB、VEGF、BDNF和FGF2,这些分子此前已被证明在啮齿动物模型的应激反应、抑郁样行为和抗抑郁反应的调节中发挥核心作用。这些分子在神经元可塑性和重塑通路中有已知的功能,证实了长期的神经元适应需要一定的时间。总的来说,这些结果支持了一种可能性,即神经胶质细胞的早期变化支持了晚期神经元适应,有助于改善行为。
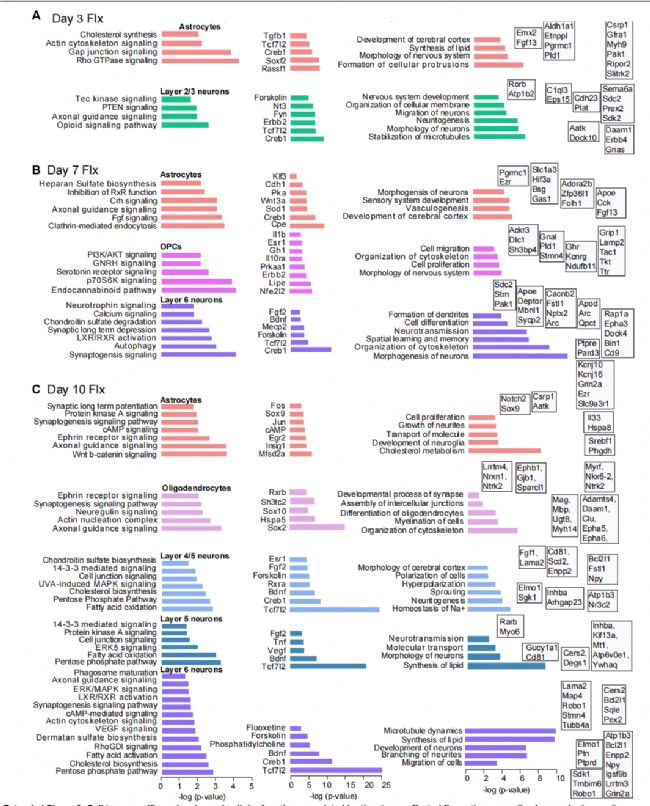
代表氟西汀反应的分子标记
接下来,研究者确定胶质细胞功能是否支持导致抗抑郁反应的晚期神经元适应。研究者选择了时间标记来跟踪氟西汀反应的时间过程。之前已经确定S100a10(p11蛋白)是一种受应激影响的重要分子,对抗抑郁反应至关重要。因此,研究者分析了S100a10调节对氟西汀治疗的动态响应。有趣的是,研究者发现S100a10的转录在时间上受到调控,仅在治疗的后期即9到14天之间受到刺激,这与观察到的行为改善的时间线更接近。因此,可以使用S100a10转录作为晚期反应阶段的代表,并通过控制S100a10的转录因子,来确定延迟反应的原因。已知p11容易被生长因子诱导,因此,研究者应用潜在的生长因子在小鼠原代混合皮层培养物中刺激S100a10转录,这是一种广泛用于研究神经元生理特性的模型系统。在受试因子中,研究者观察到BDNF和FGF2(3倍)对S100a10转录的强烈快速诱导(刺激后2h内),以及EGF(1.2倍)的小诱导。此前,已有研究人员报道过FGF2-和BDNF信号通路在情绪调节中的重要作用,以及它们提供抗抑郁药物反应的需求和充分性。此外,在MDD患者中观察到这两种因子水平降低的相关性,并在应激和抑郁动物模型中观察到它们的下调。因此,研究者的发现和文献先例使研究者选择FGF2、BDNF和S100a10表达作为时间标记物来代表氟西汀反应的时间过程。

血清素调节神经元和神经胶质细胞中FGF2、BDNF和S100a10的表达
为了定位哪一种胶质和神经细胞类型刺激了慢性血清素治疗后的FGF2、BDNF和S100a10的表达,研究者使用ACD公司的RNAscope多重荧光试剂盒v2 ( Cat #。323100)进行RNAscope多重荧光实验进行荧光原位杂交检测(FISH)。为了在单细胞水平检测单分子RNA靶标,同时用FGF2、BDNF和S100a10 mRNA的RNA探针标记混合培养,并将它们与细胞类型特异性RNA探针配对,以标记神经元和胶质细胞的亚型。用Akoya Biosciences公司的Opal 520、570、620和690试剂盒,在40℃条件下进行1h的酪氨酸信号放大反应,用共焦显微镜成像观察。
研究者发现,慢性血清素治疗在第7天刺激了星形胶质细胞中的FGF2 mRNA;在第10 ~ 14天神经元BDNF mRNA表达和S100a10 mRNA表达有变化。值得注意的是,表达BDNF的神经元与表达S100a10的神经元不同。
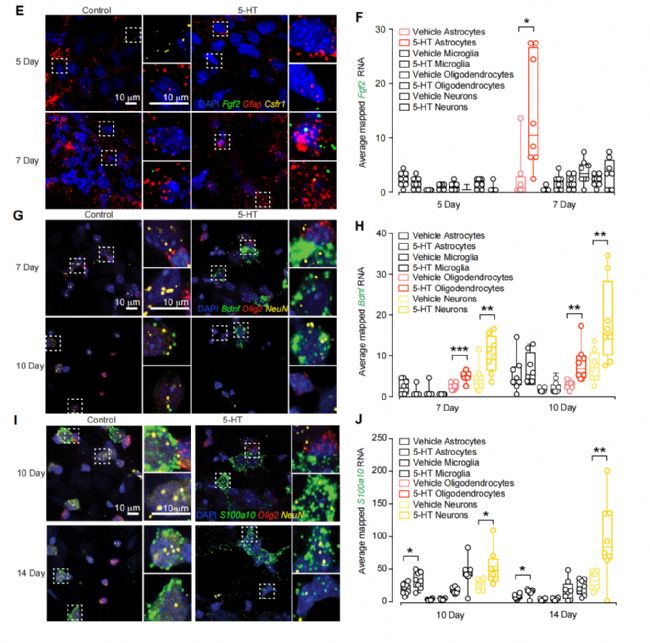
FGF2和BDNF信号之间的神经元-神经胶质依赖的交叉交流
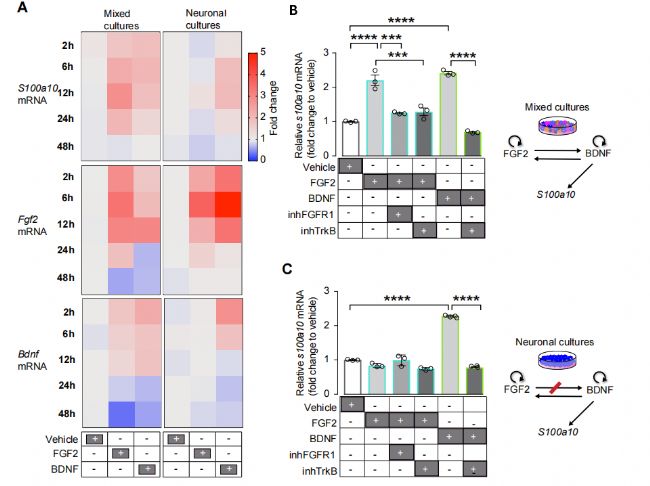
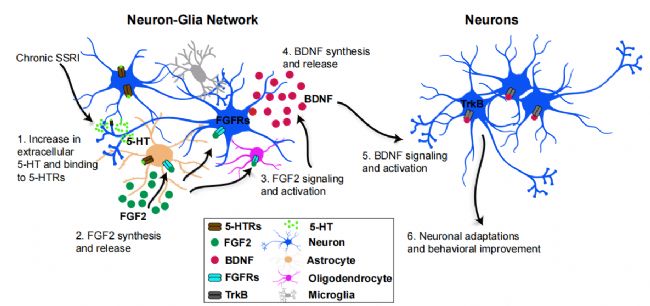
为了了解神经元-胶质细胞依赖的BDNF合成调控,研究者分析了混合培养和神经元培养中FGF2和BDNF依赖的S100a10转录调控。研究者发现FGF2仅在混合培养中诱导S100a10的转录,而BDNF在混合培养和神经元培养中均诱导S100a10的转录。这些结果表明,上游FGF2信号转导可能与需要神经胶质细胞信号转导的BDNF合成有关。接下来,研究者分析了FGF2和BDNF信号转导之间的相互作用,并观察到一种强烈的正向自动反馈调节。在混合培养和神经元培养中,应用FGF2可刺激FGF2 mRNA,而应用BDNF可刺激BDNF mRNA。有趣的是,研究者观察到一个强大的互惠交叉调节, FGF2仅在混合培养中刺激BDNF mRNA,而在神经元培养中没有。这些结果表明,依赖于fgf2的S100a10表达的刺激是通过激活BDNF-TrkB信号,需要神经元与神经胶质细胞的相互作用。因此,研究者抑制了TrkB受体的激活,并证明在混合培养中,S100a10转录的fgf2依赖刺激是通过激活TrkB信号来实现的。正如预期的那样,在混合培养和神经元培养中,抑制FGFR1受体(主要与FGF2结合)后,S100a10的FGF2刺激被下调,而抑制TrkB受体激活后,S100a10的BDNF刺激被下调。这些结果表明,FGF2仅通过依赖神经胶质细胞的方式调控BDNF合成,以及随后激活神经元中的BDNF - trkb信号通路来刺激S100a10的表达。
研究者的结果表明,关键情绪调节分子的刺激是在一个复杂的神经胶质细胞多细胞回路中进行时间调节的。
研究者建立了一个复杂的神经元-胶质细胞功能网络开始慢性氟西汀/慢性血清素治疗启动反应。这个网络涉及到星形胶质细胞中FGF2信号的顺序激活,它直接以神经元-胶质细胞依赖的方式调节BDNF的合成,随后BDNF - trkb信号的激活促进了神经元的适应(通过S100a10等基因表达的改变),这最终可能导致体内情绪的改善。因此,这项研究确定了在理解抗抑郁药延迟作用机制中所缺少的关键步骤。
小结
研究者发现,FGF2和BDNF信号的神经信号通路紧密控制着复杂的神经胶质细胞回路的功能,从而引发抗抑郁反应。研究者推测,只有通过激活神经信号通路,重新设置被破坏的神经胶质细胞回路,抗抑郁反应才可能持续。研究者的体外模型系统为新型抗抑郁药物的测试提供了一个可行的途径。进一步刻画神经胶质细胞在应激和抗抑郁反应中相互作用的关键作用,不仅将拓展研究人员对大脑稳态和修复控制机制的理解,而且还揭示了复杂行为调控的关键特征。此项研究为应激性抑郁的病理生理学和抗抑郁药物的作用机制提供了更深入的见解。
参考文章:https://doi.org/10.1101/2021.07.23.453443





