中国研究者利用10x单细胞结合空间转录组测序对人胚胎肝进行时空分析
肝脏由超过 20 种细胞类型组成,包括肝细胞、胆管细胞(胆管细胞)和各种循环免疫细胞等,它们构成了肝功能的基础,包括糖酵解和尿素代谢、免疫反应和药物解毒。肝脏还是重要的造血器官。造血干细胞和祖细胞 (HSPC) 迁移大约在人类第 6 周时进入肝芽,然后,胎儿肝脏成为主要的造血器官,并为 HSPC 增殖和分化提供特定的生态位。作为重要器官之一,肝脏容易受到体内外多种致病因素的影响,引起炎症和损伤。此外,肝脏具有很强的再生能力,肝部分切除术后,肝脏再生依赖于残余肝组织的再生能力,这引起了公众的广泛关注。因此,了解这个复杂的器官在胚胎发生过程中是如何发育的,将有助于深入了解如何设计功能性肝脏替代组织以及如何促进肝脏再生。
在过去的十年中,高通量DNA测序技术的快速发展使人们能够以前所未有的分子分辨率来研究肝脏的发育,Bulk RNA 测序 (RNA-seq) 技术使得从大块组织中获得无偏的高通量基因表达数据成为可能,但无法解决细胞异质性问题,单细胞 RNA 测序 (scRNA-seq) 是解决转录异质性的有力工具,这种单细胞分析的应用极大地促进了干细胞特性、细胞免疫、癌症诊断和发育过程的实验研究。然而,测序前的组织解离却导致细胞位置信息的丢失,从而限制了我们对胎儿肝脏发育中细胞组织和相互作用的理解,空间转录组测序可以将全转录组分析融入到带有形态背景的完整组织切片上,可对复杂的组织样本进行空间基因表达定位。
2021年5月20日,来自中国广东省自身免疫工程技术研究中心临床医学研究中心等的研究人员在Frontiers in Cell and Developmental Biology上在线发表了题为“Integrating Spatial Transcriptomics and Single-Cell RNA-seq Reveals the Gene Expression Profling of the Human Embryonic Liver”的文章,该文结合10x Genomics高通量的scRNA-seq和Visium空间基因表达解决方案的技术优势,对人类受孕后 8 周 ( 8 PCW) 和 17 周(17 PCW)的胎儿肝脏进行了无偏性分析,系统地鉴定了九种细胞类型,并定义了主要细胞类型的发育途径。结果表明,在实验研究期间,人胎肝经历了血液快速生长和迁移,并鉴定了红细胞发育过程中的差异表达基因和代谢变化。此外,研究人员还关注了肝病相关基因的表达,发现与肝病相关的17个基因主要在巨核细胞和内皮细胞中表达,在其他细胞类型中几乎没有表达。总之,这项研究全面、清晰地揭示了人胎儿肝脏各主要细胞类型的分化过程,为肝脏疾病的治疗和肝脏再生提供了重要的参考数据和信息。

ST和scRNA-seq数据鉴定人胎儿肝脏中的主要细胞类型
为了研究胎儿肝脏中免疫细胞和红细胞的发育,研究人员使用 10x Genomics Visium空间基因表达解决方案剖析了人类肝脏发育过程中的空间基因表达动态。在两个时间点(8 PCW 和 17 PCW)收集胚胎肝脏,通过H&E染色明场成像获得形态背景信息、组织透化、cDNA合成扩增、构建ST文库后测序。对测序数据进行过滤后,在 8 PCW肝脏中检测到 1,267 个高质量spot,平均每个spot包含 204,628 个干净读数、1,132 个基因和 5,924 个 UMI。在17 PCW肝脏中检测到3,489 个spot,每个spot平均有 78,576 个读数、8,829 个 UMI 和 2,266 个基因。
为了进行基因表达异质性分析,研究人员对这两种人类胚胎肝脏组织进行了单细胞测序。通过对scRNA-seq 数据进行质量控制和均一化后,分别得到了25,186 个细胞和 9,153 个细胞,每个细胞分别有 9,239 和 11,248 个独特的 UMI 以及 2,454 和 2,705 个特异性表达的基因。为了探究肝脏的细胞组成,研究者处理了单细胞数据,分别确定了 8 PCW和 17 PCW肝脏中的 31 种和 25 种细胞状态,并根据文献中已知的标记基因进行注释。
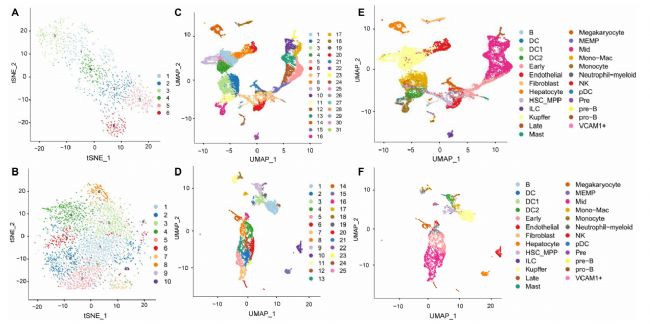
scRNA-seq 和 ST 数据的 MIA整合
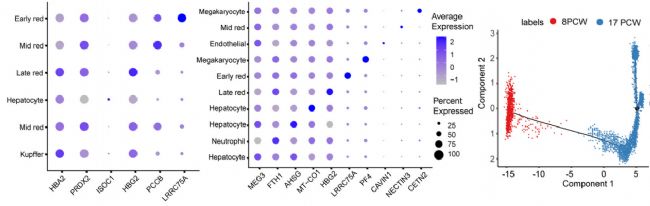
为了整合 scRNA-seq 和 ST 数据,研究者使用了MIA(Multimodal intersection analysis)方法。首先描述组织区域特异性和细胞类型特异性基因,然后确定它们的重叠是否低于或高于偶然的预期,确定了在每个空间区域(或每个细胞类型)中相对于其他区域具有显着更高表达的基因。接下来计算每对区域特异性和细胞类型特异性基因组之间的重叠,并通过超几何测试进行评估,发现肝细胞、库普弗细胞、内皮细胞和巨核细胞的高表达基因在ST和scRNA-seq数据之间显著重叠。8 PCW肝脏由库普弗、中期成红细胞、肝细胞、晚期成红细胞、早期成红细胞组成,17 PCW肝脏由肝细胞、中性粒细胞、早期成红细胞、中期成红细胞、晚期成红细胞、巨核细胞、内皮细胞和巨核细胞组成。

此外,研究者选择每种细胞类型中最独特的特征基因之一,并以点图形式呈现以比较差异。Monocle用于根据转录相似性以预测的发育轨迹(伪时间)分析细胞,结果产生了一个紧密连接的分化轨迹,分为两个主要分支,对应于不同的时期 8 PCW和17 PCW。
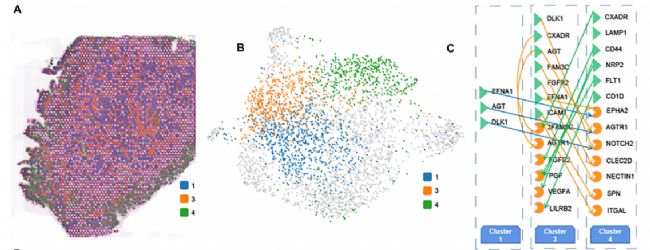
人类胎儿肝细胞的空间异质性
研究人员观察到三个不同的肝细胞群(1、3、4)沿17 PCW肝脏的空间深度分布,还描述了Cluster 1-3-4细胞之间的细胞通信,为未来的研究提供了潜在的信号转导信息。值得注意的是,尽管Cluster 3和Cluster 1的联系更紧密,但事实是Cluster 3与Cluster 4细胞的信号转导比Cluster 1更显著,。此外,研究者还发现了一些共享的和活跃的配体受体对,如DLK1-NOTCH2, EFNA1-EPHA2, AGT-AGTR1,这些配体受体对在Cluster1与Cluster 4之间以及Cluster3与Cluster4之间的细胞通信中都存在。
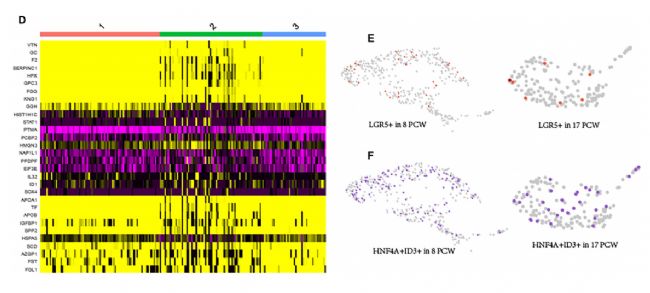
在17 PCW肝脏的scRNA-seq数据中,肝细胞进一步细分为三个群,然后对聚类间的差异基因进行了鉴定。Heatmap显示了每种聚类的前10个标记基因。最近,在肝脏发育早期的肝母细胞中发现了LGR5+干细胞和祖细胞。研究者检测了LGR5的表达模式,并根据scRNA-seq数据发现了一小部分LGR5+肝母细胞。在PCW 8时,5.68%的肝母细胞表达slgr5,而在PCW 17时,LGR5+细胞的比例下降至3.80%。此外,在8 PCW和17 PCW处存在HNF4A+ID3+肝母细胞亚群。
红细胞系在胎肝中的分化和成熟途径
在8 PCW肝脏中,小团红细胞分散在肝脏各处。在17 PCW肝脏中,肝脏充满了红细胞并完全变红。值得注意的是,早期成红细胞位于肝组织的外围,中期成红细胞和晚期成红细胞分散在肝组织的中心区域。这种戏剧性的形态变化表明,在实验研究期间,人类胎儿肝脏经历了血液的快速生长和迁移,8 PCW和17 PCW均有早期、中期、晚期成红细胞。为了研究红细胞的发育过程,研究者分析了这三种类型红细胞之间的基因差异表达。
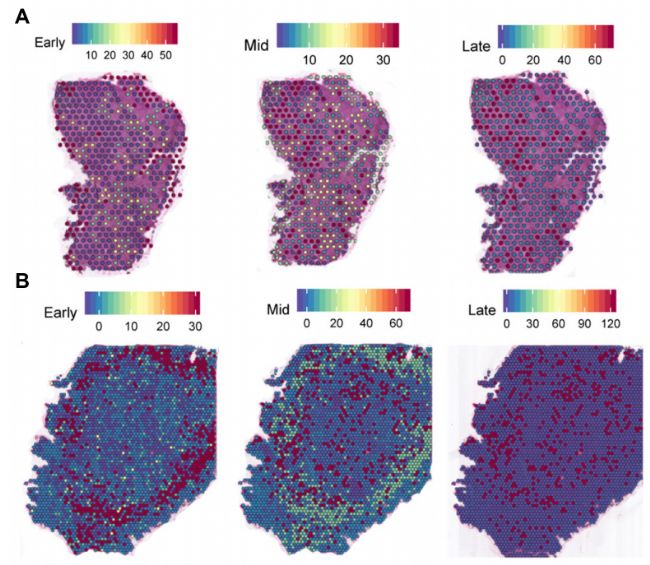
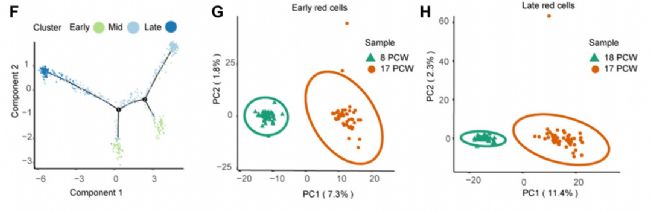
此外,对红细胞的分化轨迹进行分析,得到了一个紧密相连的分化轨迹,分化为五个主要分支。这表明系统是通过一个连续的血统而不是几个不相连的血统来维持的。此外,在8 PCW和17 PCW肝脏的早期、中期和晚期成红细胞中分别鉴定出617、674和503个DEGs。为了进一步了解8 PCW肝脏和17 PCW肝脏红细胞的差异,研究者对两个胚胎期的基因表达模式进行了PCA分析。从每个细胞类型中选取50个点,生成均衡的数据集,发现8 PCW和17 PCW肝脏的所有点都可以根据转录相似性进行区分。
肝脏疾病相关基因在胎儿肝组织中的表达模式
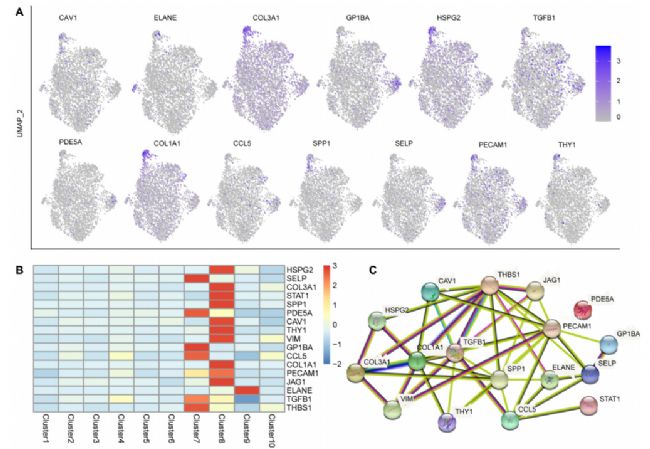
为了鉴定与胎儿肝脏起源相关的基因,研究者将胎儿肝脏ST数据与一个公开的网络资源整合,以可视化地探索与肝脏疾病相关的细胞类型和空间位置信息。发现17个与肝脏疾病相关的基因主要在巨核细胞和内皮细胞中表达,在其他细胞类型中几乎不表达。此外,对这17个肝病相关基因的蛋白互作网络分析显示,TGFB1、COL1A1、SPP1、PECAM1、THBS1在表达网络中起关键作用,而PDE5A与其他基因无互作。
胚胎肝发育基因的加权基因共表达网络分析
为了更好地理解肝脏发育相关的基因调控变化和细胞类型之间的相互作用,研究者使用WGCNA算法基于主要细胞群中差异表达的基因构建了ST数据的无偏共表达分析。在8 PCW肝脏中鉴定了5个主要的共表达模块,在17 PCW肝脏中定义了2个基因表达模块。对这些模块的研究表明,许多模块由在特定细胞群中优先表达的基因组成。此外,高相关模块往往包含丰富的KEGG通路、GO生物过程和蛋白-蛋白相互作用(PPI)网络,进一步突出了基因功能中的协作模式。此外,细胞群(或细胞类型)之间的细胞通讯和信号转导调控是胎儿肝脏发育的最早过程。为了研究胎儿肝脏中的细胞通信和空间交流,研究者进行了配体-受体相互作用分析,发现细胞群之间存在活跃的细胞通信。

胎儿肝细胞的细胞周期阶段分析
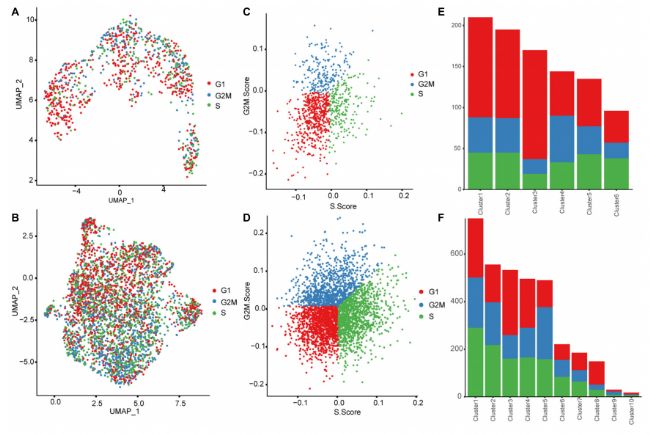
利用CellCycleScoring算法,研究人员鉴定了胎儿肝细胞的细胞周期阶段,发现17 PCW肝脏中增殖肝细胞(S期和G2/M期细胞)的比例(~ 57.95%)高于8 PCW肝脏中增殖肝细胞的比例(~ 21.76%),这种现象也存在于红细胞的发育过程中,从8 PCW 的早期59.38%,中期57.04%,后期 62.50%增加到17 PCW的前期 70.14%,中期73.33%,晚期76.94%。因此,在ST数据中,肝细胞和红细胞的增殖率在整个发育过程中均有所增加。
总 结
胎儿肝脏的发育是一个复杂的过程,包括迁移、分化和许多来源于中胚层和内胚层的细胞系间的相互作用,而我们对人类胎儿肝在子宫内的发育知之甚少。
在这项研究中,研究者鉴定了不同的细胞状态、亚群和胎儿肝组织中的细胞类型。首先通过scRNA-seq对肝脏组织中存在的细胞群和细胞类型进行表征,同时,通过ST对转录组区域进行鉴定。通过MIA将ST数据和scRNA-seq数据整合在一起,并对感兴趣区域的数据进行无偏性分析,绘制了胎儿肝组织中不同细胞类型和亚群的位置(8 PCW肝脏中有2个不同的中期红细胞群,17 PCW肝脏中有3个肝细胞群和2个巨核细胞群),以及细胞类型之间的关系。在ST和scRNA-seq数据中鉴定了三个肝细胞亚群,每个亚群显示了不同的基因表达和功能富集,说明不同区域的肝细胞可能具有不同的功能。
在实验研究期间,人胎儿肝脏经历了血液的快速生长和迁移。在早-中晚期分化过程中,大量基因逐渐上调或下调。在ST数据中,肝细胞和红细胞的增殖率在整个发育过程中增加。
此外,研究者还关注了肝脏疾病相关基因在胚胎肝中的表达,发现有17个已发表并与肝脏疾病相关的基因主要表达于巨核细胞和内皮细胞,在其他细胞类型中几乎不表达。肝星状细胞(HSCs)中的转化生长因子-b1 (TGF-b1)信号通路通过启动HSCs的促纤维化信号通路和胶原合成在肝纤维化中起着至关重要的作用,但TGFb1的来源尚不清楚,而这项研究发现了巨核细胞富含TGF-b1。在急性肝损伤期间,阻断巨核细胞和TGF-b1活化是否可以预防肝纤维化,还需要进一步的研究。嗜肝病毒(乙型肝炎病毒、丙型肝炎病毒等)通常通过肝窦内皮细胞(LSECs)构建的保护性过滤器进入肝实质,LSECs可组成性地表达大量的抗炎细胞因子(如TGF-β)、共刺激分子等,使肝脏免疫平衡向耐受方向转变。由于许多慢性肝炎患者常发生肝纤维化,因此了解lsec在肝病发展过程中的变化和功能至关重要,lsec在肝脏疾病的临床诊断和新的靶向治疗领域具有良好的前景。
综上所述,将scRNA-seq数据与空间转录组数据相结合,能够整合单细胞和空间位置信息,并清晰全面地了解人类胎儿肝脏中所有细胞类型的分化过程,可为进一步研究免疫和感染性肝病的致病机制和治疗靶点提供参考。
参考文献:
Hou X, Yang Y, Li P, Zeng Z,Hu W, Zhe R, Liu X, Tang D, Ou Mand Dai Y (2021) Integrating Spatial Transcriptomics and Single-Cell RNA-seq Reveals the Gene Expression Profling of the Human Embryonic Liver. Front. Cell Dev. Biol. 9:652408.doi: 10.3389/fcell.2021.652408.





