实验室选择CO2培养箱的最佳方法和技巧
如何为您的实验室选择 CO2 培养箱

摘要
CO2 培养箱的用途是通过控制恒温加湿环境中的二氧化碳气体浓度,以确保维持最佳的细胞生长环境。现代的 CO2 培养箱为污染防治、有效利用实验室空间甚至特定需求提供专业化的解决方案,例如支持低氧应用。在本指引中,我们为您提供选择最佳培养箱的方法和技巧,以满足您的需求。
选择合适的型号
在过去,选择 CO2 培养箱被认为是一种日常采购行为,经常基于以前的使用经验。现在,由于出现了大量可选的规格和专业功能,值得考虑自身的需求,仔细分析并选择合适的培养箱,本指南给予您帮助。
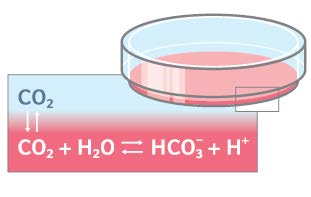
最常用的 CO2-碳酸氢盐缓冲系统依赖于 5-10%的CO2 浓度,可产生 7.2 至 7.4的 pH 值。
腔内气体控制
控制培养箱内的温度、CO2 浓度以及湿度对于培养细胞的健康和生长非常关键。对于大多数哺乳动物细胞系而言,最佳生长温度为37°C,大约 95%的加湿环境可避免培养物干燥。培养基缓冲系统需要使用 CO2 调节 pH值。
温度: 尽管市场上仍有水套式培养箱,但最先进的系统采用直热式、气套式或者两者的组合。在直热式培养箱中,通过直接放置在外表面上的电加热元件加热培养腔。在气套式加热系统中,热空气在培养腔外部和隔热层之间的空隙中循环。两种系统需要的维护都要少于水套式培养箱,这是因为没有水套,就无需补充和清空水,因此重量更轻、更紧凑、占用的实验室空间更小。另外,培养腔表面不会有渗水风险,因此培养箱可以采用高温消毒方式进行自行灭菌。
Eppendorf 解决方案:采用 Eppendorf 六面直热式技术,可从全部 6 个侧面加热培养腔,包括外门在内。采用多个快速反馈传感器和先进的微处理器控制,可调节 4 个独立的加热回路,保证培养腔内温度均匀。加热元件的特定布置能够实现培养腔空气的自然温和对流循环(图 1)。这有助于避免培养箱内出现“凉点”,从而产生优异的温度稳定性(37°C 时为±0.1 °C)和均匀性(±0.3°C),还可以避免温度波动过大,否则会对细胞产生影响。开门后的快速恢复温度不需要风扇,从而减少传统设备的污染风险和振动源。
CO2 感应器:与热导(TC)感应器相比,使用红外(IR)感应器测量 CO2 浓度不受温度和湿度波动影响。频繁开门会导致温度和相对湿度产生波动,这 也会影响热导感应器的准确度。可能检测不出瞬时CO2 的变化,IR 传感器更不容易受开门干扰的影响。有的甚至能够承受高温,可以用于培养箱高温消毒 过程。
Eppendorf 解决方案:为了精密控制CO2,Eppendorf CO2 培养箱采用双通道红外(IR)感应器和先进的微处理器控制,确保高度均匀的气体浓度和开门后的快速恢复。先进的 CO2 感应器技术确保长期、无偏离和准确测量 CO2 浓度。
湿度:在多数系统中,装有无菌蒸馏水的湿度控制盘-通过被动蒸发产生湿度,它们保持大约 95%的相对湿度水平。
Eppendorf 解决方案:CellXpert® C170i 培养箱配备单个水盘,易于拆卸清空、清洗和装水,没有其它需要清洗的排水阀。

图 1: Eppendorf 六面直热式技术使培养腔气体能够温和地对流循环,保持整个培养腔内稳定的温度和 CO2 控制。
氧气控制:大气中含有大约 21%的氧气,细胞的生理性含氧浓度通常为 1%至 13%。人们已发现氧气浓度是影响干细胞生长和发育等的关键环境因素[4]。这就是为什么各新兴领域的科学家,例如干细胞研究,逐渐明白控制氧气、CO2 和温度的价值所在。如今大多数培养箱可选配氧气控制。通过向培养腔 内提供氮气,控制培养箱中的氧气水平。因为某些 培养箱消耗大量昂贵的氮气,所以有的培养箱为了 控制腔内的氧气浓度会明显增加耗气成本。
Eppendorf 解决方案:CellXpert C170i 可选氧气控制,用于产生低氧环境,该功能可工厂安装或者直接在实验室升级。该氧气感应器精密测量 O2 浓度, 可用于培养箱高温消毒过程。由于低氮气消耗和开门后快速恢复,CellXpert C170i 可为低氧应用提供最佳环境,例如培养干细胞或肿瘤细胞。
污染控制
除了可靠的腔内气体控制和内置自动消毒装置外, 培养箱的创新设计可以帮助细胞培养研究人员克服最大的挑战——污染。
一项主要措施是安装 HEPA(高效空气过滤器),该过滤器用于生物安全柜中。这需要在腔内添加许多复杂部件,包括风扇和管道,将气体吸入通过过滤器,并在培养腔中重新分布。虽然腔内气体已经过滤,但仍有若干缺点。由于内部结构更复杂,有更多位置隐藏污染物,包括接缝和边角。由于无法处理操作中溅出的培养基,导致细菌滋生风险,从而需要浪费更多时间拆卸这些装置进行清洁和消毒。加压气流还会干扰培养的细胞并加速培养基干燥。除此之外,更重要的是需要定期维护和购买新过滤器。另外,过滤器会成为污染源,导致其带来的缺点比优势更多。
另一项措施是增加培养腔的紫外线照射剂量,据称 能消除培养腔内气体和水中的微生物。通常在承液 盘上盖上通风罩板,将紫外线灯与细胞培养腔分开。打开内门后,该灯自动打开一定时间,照向循环加 湿空气和承液盘中的水。定向气流需要在培养箱背 面加装风扇和管道。尽管人们已经发现使用紫外线 可有效处理培养箱中的气体和水[1],但也发现相对 湿度超过 70%时会对紫外线有效性产生不良影响[2]。紫外线只能对其直接照射的表面进行消毒。培养箱 内部结构复杂,因此紫外线无法到达许多表面进行 消毒。另外,必须定期更换紫外线灯,保持其有效 性。
与风扇辅助的培养箱内强制气流相比,无风扇培养 箱通过对流温和地循环气流。湍流的潜在风险—— 样品干燥、振动和污染物进一步传播得以全部消除。无风扇培养腔的设计没有复杂内部结构,不会隐藏 污染物。由于采用平面设计、无接缝和死角,污染 物极少有机会生长而不被发现。
如果出现培养基溅出,可以立即清洁,因为易于擦拭培养腔体的所有表面。最近发布的细胞培养规范指导建议采用无风扇辅助的培养箱,可有效降低培养箱内的污染传播[3]。
Eppendorf 解决方案:培化繁为简的培养箱腔体设计。Eppendorf CO2 培养箱的无风扇培养腔体设计, 采用一体成型不锈钢材料制成,无接缝或死角(图2)。Eppendorf 直热技术取消了风扇和复杂的内部装置。这种优雅简约的设计策略是避免死角或气道内微生物滋生,从而特别容易清洁和消毒。可以现场检测和消除污染,所有表面区域都易于擦拭和消毒。层架系统和搁板可 2 分钟内拆卸完毕。
一项主要措施是安装 HEPA(高效空气过滤器),该过滤器用于生物安全柜中。这需要在腔内添加许多复杂部件,包括风扇和管道,将气体吸入通过过滤器,并在培养腔中重新分布。虽然腔内气体已经过滤,但仍有若干缺点。由于内部结构更复杂,有更多位置隐藏污染物,包括接缝和边角。由于无法处理操作中溅出的培养基,导致细菌滋生风险,从而需要浪费更多时间拆卸这些装置进行清洁和消毒。加压气流还会干扰培养的细胞并加速培养基干燥。除此之外,更重要的是需要定期维护和购买新过滤器。另外,过滤器会成为污染源,导致其带来的缺点比优势更多。
另一项措施是增加培养腔的紫外线照射剂量,据称 能消除培养腔内气体和水中的微生物。通常在承液 盘上盖上通风罩板,将紫外线灯与细胞培养腔分开。打开内门后,该灯自动打开一定时间,照向循环加 湿空气和承液盘中的水。定向气流需要在培养箱背 面加装风扇和管道。尽管人们已经发现使用紫外线 可有效处理培养箱中的气体和水[1],但也发现相对 湿度超过 70%时会对紫外线有效性产生不良影响[2]。紫外线只能对其直接照射的表面进行消毒。培养箱 内部结构复杂,因此紫外线无法到达许多表面进行 消毒。另外,必须定期更换紫外线灯,保持其有效 性。
与风扇辅助的培养箱内强制气流相比,无风扇培养 箱通过对流温和地循环气流。湍流的潜在风险—— 样品干燥、振动和污染物进一步传播得以全部消除。无风扇培养腔的设计没有复杂内部结构,不会隐藏 污染物。由于采用平面设计、无接缝和死角,污染 物极少有机会生长而不被发现。
如果出现培养基溅出,可以立即清洁,因为易于擦拭培养腔体的所有表面。最近发布的细胞培养规范指导建议采用无风扇辅助的培养箱,可有效降低培养箱内的污染传播[3]。
Eppendorf 解决方案:培化繁为简的培养箱腔体设计。Eppendorf CO2 培养箱的无风扇培养腔体设计, 采用一体成型不锈钢材料制成,无接缝或死角(图2)。Eppendorf 直热技术取消了风扇和复杂的内部装置。这种优雅简约的设计策略是避免死角或气道内微生物滋生,从而特别容易清洁和消毒。可以现场检测和消除污染,所有表面区域都易于擦拭和消毒。层架系统和搁板可 2 分钟内拆卸完毕。

图 2: 易于清洁的 Eppendorf 培养腔体,一体成型,采用圆角和平滑的无接缝表面设计,避免死角处产生污染,能够快速和方便地维护清洁。
内置的自动化自消毒
上述所有措施均不能替代常规培养箱的全面清洁和消毒处理,包括对消毒装置所有部件的清洁和擦拭。培养箱集成自动消毒程序,提供更多安全措施。现在,培养箱可选各种内置的自动化自消毒系统, 从湿热或干热到过氧化氢(H2O2)雾化消毒。
H2O2 雾化比加热除污更快,但需要使用毒性试剂以及定期购买制造商规定的试剂。
湿热消毒程序冗长,包括排水、表面消毒和重装水盘。另外,消毒结束时培养腔中还会残留冷凝水, 增加了再次污染的风险。必须对培养腔进行最终擦拭消毒,清除冷凝水。
干热消毒可以整夜运行,制备时间最短。因为培养箱可以直接使用,再次污染的机会最低。注意:高温消毒过程中,HEPA 过滤器不能置于培养箱内。
H2O2 雾化比加热除污更快,但需要使用毒性试剂以及定期购买制造商规定的试剂。
湿热消毒程序冗长,包括排水、表面消毒和重装水盘。另外,消毒结束时培养腔中还会残留冷凝水, 增加了再次污染的风险。必须对培养腔进行最终擦拭消毒,清除冷凝水。
干热消毒可以整夜运行,制备时间最短。因为培养箱可以直接使用,再次污染的机会最低。注意:高温消毒过程中,HEPA 过滤器不能置于培养箱内。
Eppendorf 解决方案:可选高温干热自动化消毒装置,提高去除污染的安全性。一键即可启动高温消毒程序。可将培养腔体加热至高达 140 或 180°C(取决于型号),过夜即可方便地完成整个过程。已使用耐热芽孢枯草杆菌测试和验证 HTD(高温消毒) 程序的灭杀效率。
其它选择标准
有限实验室空间:现在多数培养箱都可互相叠放, 以节省宝贵的实验室空间。最好将培养箱放置在装有脚轮的底座上,能够移动进行清洁和检修。在打开培养箱时,也可避免地面的微生物或灰尘进入箱内。
Eppendorf 解决方案:Eppendorf 提供可靠的叠放支架(图 3)。底座包括重型脚轮,可以单独订购,用于单台培养箱摆放。
其它选择标准
有限实验室空间:现在多数培养箱都可互相叠放, 以节省宝贵的实验室空间。最好将培养箱放置在装有脚轮的底座上,能够移动进行清洁和检修。在打开培养箱时,也可避免地面的微生物或灰尘进入箱内。
Eppendorf 解决方案:Eppendorf 提供可靠的叠放支架(图 3)。底座包括重型脚轮,可以单独订购,用于单台培养箱摆放。

参考文献
1.Busujima H., Mistry D. A Comparative Analysis of Ultraviolet Light Decontamination versus High Heat Sterilization in the Cell Culture CO2 Incubator with the Use of Copper-Enriched Stainless Steel Construction to Achieve Active Back¬ground Contamination Control™.American Biotechnology Laboratory; February 2007
2.Burgener J., Eli Lilly and Company, Indianapolis, Position Paper on the Use of Ultraviolet Lights in Biological Safety Cabinets 228 Applied Biosafety (2006), 11 (4), 228-230.
3.Geraghty RJ, Capes-Davis A, Davis JM, Downward J, Freshney RI, Knezevic I, Lovell-Badge R, Masters JRW, Meredith J, Stacey GN, Thraves P, Vias M. Guidelines for the use of cell lines in biomedical research, British Journal of Cancer (2014), 1-26 | doi: 10.1038/bjc.2014.166.
4.Mohyeldin A., Garzon-Muvdi T., Quinones-Hinojosa A. Oxygen in Stem Cell Biology: A Critical Component of the Stem Cell Niche, Cell Stem Cell (2010) 7(2), 150-161.
标签:
CO2培养箱





