美国计量院研讨会关于细胞治疗产品活率测量技术开发探讨重点汇总
引言
继2017年美国国家标准与技术研究院(NIST, 简称美国国家计量院) 和食品与药物管理局(FDA)举办了一场专注于细胞计数的研讨会后,2020年12月15日,NIST和Nexcelom Bioscience联合举办了一场关于细胞活率的研讨会。超过40位细胞治疗行业的相关人员参加了此次研讨会,共同探讨了当前细胞治疗产品活率测量领域面临的挑战。会议讨论结果发表在了Cell & Gene Therapy Insights. 以下正文是文献的全篇翻译。
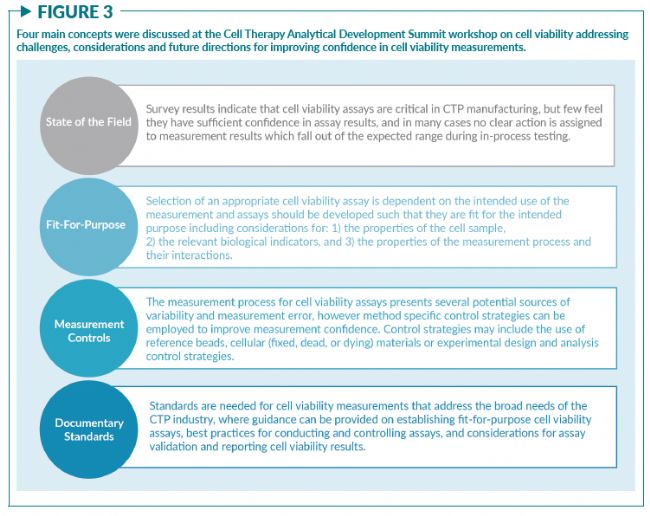
- 与会者一致认同细胞活率测量方法的开发必须遵循fit-for-purpose (量体裁衣)的原则,选择符合既定目的与既定用途(比如细胞计数传代,细胞杀伤实验和确定CTP的剂量和纯度)的方法。
- 一个fit-for-purpose的活率测量方法必需综合考虑生物学指标的选择(细胞膜通透性、代谢水平、分子标志物等),细胞样本的属性(红细胞残留、聚集程度等),和方法的性能标准(准确度、精密度、耐用性等)。
- 测量方法的选择会影响细胞活率的结果,比如1)由于样本中存在红细胞残留,明场成像和台盼蓝染色将对原代细胞样本的活率测量产生显著影响;2)台盼蓝染料和染色时间会影响死亡和濒死的免疫细胞群;3)基于液流系统的机械应力会在测量过程中改变细胞活率。
- 通过实施控制策略可以提高活率测量的置信度。NIST演示了针对三种基于图像原理的测量方法的控制策略,用以监控和应对由测量过程中特定节点引起的潜在变化。
- 对照材料,如商品化的参考微珠和实验室制备的固定死细胞样本,可用于建立细胞活率测量中的控制策略。不过目前还尚未有任何一类参考物质被认证可充分代表各种类型的细胞样本。对照材料的属性范围应该与待测细胞样本的属性范围一致。
- 细胞活率的结果报告应包含测量使用的方法和所测生物指标的信息。例如,当报告一个细胞样本的活率为70%时,需附加更具体的信息(比如用基于成像分析原理的AO/PI染色法测得)。
- 细胞活率测量的通用标准尚在开发中。一套支持选择、开发和验证fit-for-purpose的细胞活率测量方法的标准将有助于加速细胞治疗产品的开发。
介绍
细胞活率是细胞治疗产品(即以细胞作为活性物质的产品,比如CAR-T细胞疗法)生产和放行的基本测量指标之一。评估细胞治疗产品 (CTP) 中活细胞、死细胞或濒死细胞的存在至关重要。死细胞、濒死细胞和细胞碎片可能会引发不必要的免疫反应;活细胞太少则可能会降低产品的有效性。活率检测也可以作为确定CTP的强度或剂量(即活细胞浓度)的方法,并作为细胞毒性检测的一部分,用来评估CAR-T的效力。除了在产品表征和放行检测中需要评估细胞活率外,活率的测量也可以作为过程控制的指标之一,为整个生产过程的决策提供关键信息(图1)。
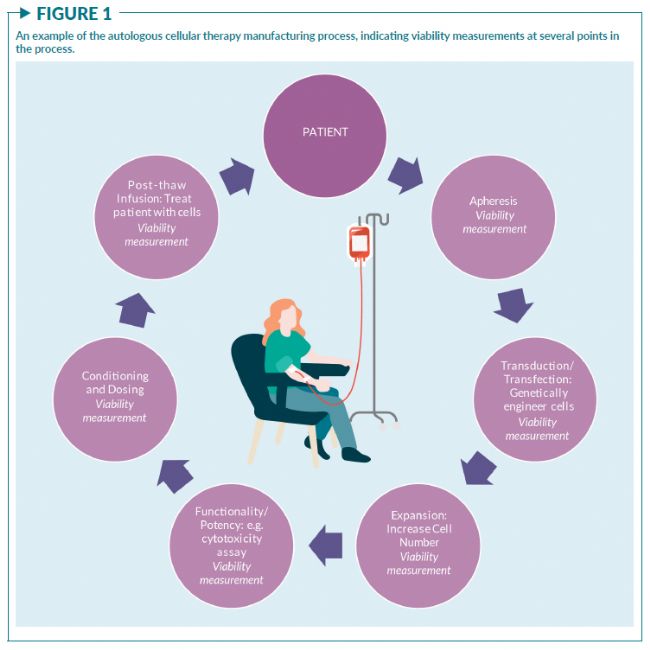
活细胞和死细胞的定义通常被认为是对细胞健康连续动态变化的瞬时解读。由于现有的细胞活率测量原理、方法和检测仪器多种多样,以及评估细胞活率的目的各不相同(图2),细胞治疗行业亟需更为严格的方法来选择、设计和控制细胞活率测量。

2020年12月15日,美国国家标准与技术研究院 (NIST,简称美国国家计量院)和Nexcelom Bioscience在“细胞疗法分析开发峰会”上联合举办了一场关于细胞活率的研讨会,包含了三场主题演讲:“细胞活率测量:我们真正测量的是什么?”“你选择的测量方法如何影响活率结果?” 以及“实验案例和测量控制” 。每一个环节都探讨了在细胞治疗行业中细胞活率测量遇到的共同挑战,并讨论了如何以“fit-for-purpose”(量体裁衣)的方式选择细胞活率的测量方法。超过40位来自于生物技术企业、制药公司、设备供应商、科研实验室和政府实验室的相关人员加了此次研讨会,讨论了如图3所示的四个主要议题。
问卷调查结果
二十四位与会者参与了一项问卷调查,询问在进行细胞活率测量时遇到的共同问题和挑战。问卷结果显示最常见的问题是不确定测量方法的准确性,其次是不了解测量结果与产品效力的相关性。整个行业遇到的一个共同挑战是测量方法的选择。79%的参与者表示,他们在选择细胞活率测量方法时最重要的考虑因素是测量的质量,即通过准确性、精密度、特异性和可重复性等指标来衡量。在细胞活率测量所基于的生物指标方面,最常用的测量方法是荧光细胞核染色法(83%受访者)。
基于fit-for-purpose 原则的方法开发
在整个研讨会中,与会者都强调了以fit-for-purpose (量体裁衣,符合既定目的与既定用途)为原则开发细胞活率测量方法的必要性。基于活率测量的预期目的(例如在CTP生产过程中,初始单采分离物的表征,在扩增过程中监测细胞,或用于产品放行等),可以通过三方面的考量来选择fit-for-purpose的方法:
- 1) 选择合适的生物学指标;
- 2) 考虑细胞样本的属性;
- 3) 考虑测量方法的性能标准(图4)
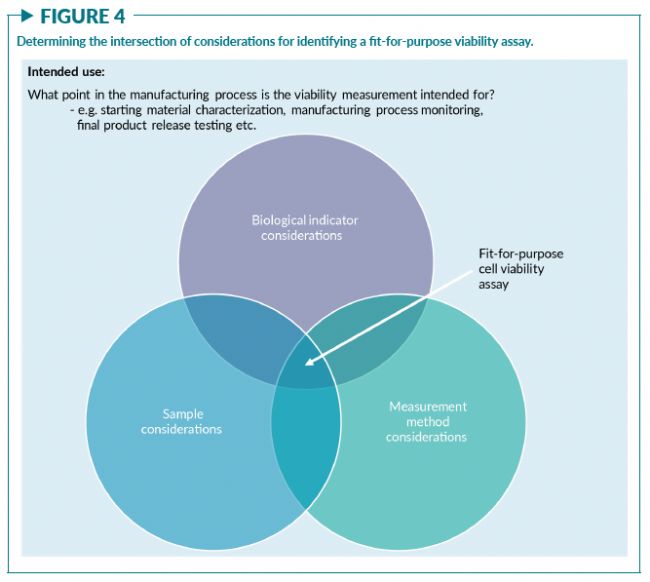
这三个方面的相互作用将主导测量系统的构建。研讨会上关于样品属性和测量方法之间相互作用的例子在“选择的测量方法会影响活率结果”一节中给出。
图1显示了一个典型的CTP生产流程,标注了需要细胞活率测量的几个环节。评估细胞活率的分析方法可能因所处不同步骤而不同。例如,在CAR-T生产过程中,新鲜分离或冷冻保存的PBMC样本中可能存在RBC残留或碎片。在这种情况下,细胞活率和计数方法必须仅计数有核细胞,避免对红细胞、血小板和碎片的非特异性计数。而在生产流程的下游环节,比如在细胞扩增或放行前的效力检测时,样本会更纯净。针对这些样本选择的活率测量方法可能会与在生产早期测量PBMC的方法不同。
细胞活率测量的另一个预期用途是体外细胞毒性检测。在进行检测之前,需要对效应细胞和肿瘤靶细胞进行准确的细胞数量和活率测量,来正确评估效应细胞的杀伤能力。细胞活率测量的误差可能会错误地评估效应细胞的特异性杀伤功能。在这种情况下,效应细胞和靶细胞的活率测量可能会因这些细胞的不同属性(即浓度、形态、稳定性等)而不同。
在讨论期间,细胞样本的属性也是建立fit-for-purpose活率测量方法的一个重要考虑因素。样本可以有各种各样的属性,包括不同水平的碎片、污染细胞系、形态特征、聚集性和脆弱度。在确定适合的测量方法时,通常要考虑样品的基本性质,如浓度范围、细胞类型和悬浮溶液。进一步的考虑包括细胞的状态,样品中可能存在的受污染的细胞或碎片,以及在活率测量期间细胞样本的稳定性。细胞的状态可能受到在活率分析之前经过的处理的影响。例如,冷冻后直接解冻的细胞测得的活率可能与新鲜制备的细胞不同。细胞活率评估的时间也可能影响活率测量的结果,比如当细胞从冻存中复苏或持续培养中恢复时,其属性可能发生改变。此外,也需要考虑样本是否有足够的量用于测量。如果样本量有限,一个fit-for-purpose的方法需要体积尽可能小的样品量进行分析。其他需要考虑的实际因素还包括每次分析的成本、通量、自动化需求或培训需求,以及法规或其他方面。
当开发一个合适的活率测量方法时,样品在分析期间的稳定性也应该是一个重要的考虑因素。活率测量通常是一个瞬时行为,为活和死的连续过程捕获离散的信息。细胞样本的活率可能随时间或样品制备过程而改变,死细胞和污染碎片可能会增加,或在测量过程中由于细胞粘附到离心管壁或移液管而导致细胞丢失。例如,在流式细胞术染色过程中进行的样品清洗步骤可能会去除部分失活细胞群而影响活率测量。细胞样本中污染细胞或碎片的存在是建立活率测量方法的另一重要考虑因素,方法对目标细胞群的特异性识别至关重要。
关于细胞样本的另一个考虑因素是样本间的异质性。当用于分析的样本之间差别很大时,比如样本来自于患有不同程度疾病的捐献者,一个fit-for-purpose的方法必须可接纳这种差异性,且必须用同等程度差异性的样本对方法进行验证。
开发细胞活率测量方法除了需要考虑样本属性和生物指标,还需考虑方法的性能标准(如准确度、精密度、灵敏度、线性和耐用性)。确保测量置信度的控制策略也应纳入fit-for-purpose的细胞活率测量方法中。NIST在研讨会上介绍了几种控制策略,并在“通过控制策略提高活率测量的置信度”一节中进行了描述。
与会者一致认为需要选择“fit-for-purpose”的细胞活率测量方法以满足预期目的,包括细胞计数传代,细胞杀伤实验和确定CTP的剂量和纯度。图4表明,细胞活率测量方法的开发最好可以兼顾细胞样本属性、测量方法和生物指标三方面的考量,以支持其预期的用途。
图1显示了一个典型的CTP生产流程,标注了需要细胞活率测量的几个环节。评估细胞活率的分析方法可能因所处不同步骤而不同。例如,在CAR-T生产过程中,新鲜分离或冷冻保存的PBMC样本中可能存在RBC残留或碎片。在这种情况下,细胞活率和计数方法必须仅计数有核细胞,避免对红细胞、血小板和碎片的非特异性计数。而在生产流程的下游环节,比如在细胞扩增或放行前的效力检测时,样本会更纯净。针对这些样本选择的活率测量方法可能会与在生产早期测量PBMC的方法不同。
细胞活率测量的另一个预期用途是体外细胞毒性检测。在进行检测之前,需要对效应细胞和肿瘤靶细胞进行准确的细胞数量和活率测量,来正确评估效应细胞的杀伤能力。细胞活率测量的误差可能会错误地评估效应细胞的特异性杀伤功能。在这种情况下,效应细胞和靶细胞的活率测量可能会因这些细胞的不同属性(即浓度、形态、稳定性等)而不同。
在讨论期间,细胞样本的属性也是建立fit-for-purpose活率测量方法的一个重要考虑因素。样本可以有各种各样的属性,包括不同水平的碎片、污染细胞系、形态特征、聚集性和脆弱度。在确定适合的测量方法时,通常要考虑样品的基本性质,如浓度范围、细胞类型和悬浮溶液。进一步的考虑包括细胞的状态,样品中可能存在的受污染的细胞或碎片,以及在活率测量期间细胞样本的稳定性。细胞的状态可能受到在活率分析之前经过的处理的影响。例如,冷冻后直接解冻的细胞测得的活率可能与新鲜制备的细胞不同。细胞活率评估的时间也可能影响活率测量的结果,比如当细胞从冻存中复苏或持续培养中恢复时,其属性可能发生改变。此外,也需要考虑样本是否有足够的量用于测量。如果样本量有限,一个fit-for-purpose的方法需要体积尽可能小的样品量进行分析。其他需要考虑的实际因素还包括每次分析的成本、通量、自动化需求或培训需求,以及法规或其他方面。
当开发一个合适的活率测量方法时,样品在分析期间的稳定性也应该是一个重要的考虑因素。活率测量通常是一个瞬时行为,为活和死的连续过程捕获离散的信息。细胞样本的活率可能随时间或样品制备过程而改变,死细胞和污染碎片可能会增加,或在测量过程中由于细胞粘附到离心管壁或移液管而导致细胞丢失。例如,在流式细胞术染色过程中进行的样品清洗步骤可能会去除部分失活细胞群而影响活率测量。细胞样本中污染细胞或碎片的存在是建立活率测量方法的另一重要考虑因素,方法对目标细胞群的特异性识别至关重要。
关于细胞样本的另一个考虑因素是样本间的异质性。当用于分析的样本之间差别很大时,比如样本来自于患有不同程度疾病的捐献者,一个fit-for-purpose的方法必须可接纳这种差异性,且必须用同等程度差异性的样本对方法进行验证。
开发细胞活率测量方法除了需要考虑样本属性和生物指标,还需考虑方法的性能标准(如准确度、精密度、灵敏度、线性和耐用性)。确保测量置信度的控制策略也应纳入fit-for-purpose的细胞活率测量方法中。NIST在研讨会上介绍了几种控制策略,并在“通过控制策略提高活率测量的置信度”一节中进行了描述。
与会者一致认为需要选择“fit-for-purpose”的细胞活率测量方法以满足预期目的,包括细胞计数传代,细胞杀伤实验和确定CTP的剂量和纯度。图4表明,细胞活率测量方法的开发最好可以兼顾细胞样本属性、测量方法和生物指标三方面的考量,以支持其预期的用途。
测量方法的选择会影响细胞活率的结果
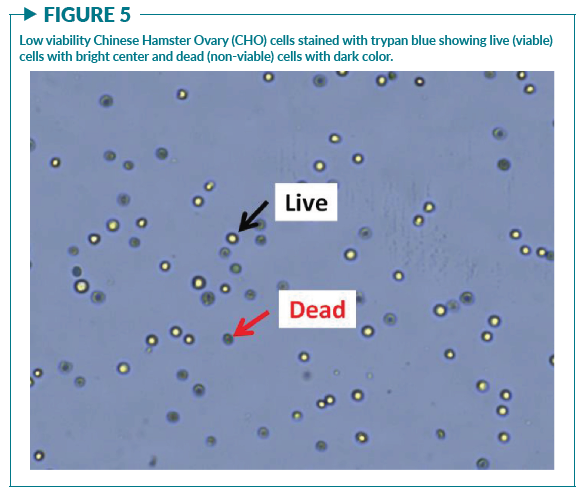
测量方法本身会影响样本,从而影响细胞活率的检测结果。确定细胞活率的方法有多种,有的可以直接计算出样本中总细胞、活细胞和死细胞的数量。这种情况下细胞活率并不是一个测量值,而是通过计算活细胞数占总细胞数的比例获得。例如,台盼蓝染色法会分别计数活细胞(明亮的中心)和死细胞(深蓝色)(图5),再计算活率,使用公式为
因此,如果细胞计数结果由于测量方法而受到干扰,则活率结果也会受到显著影响。研讨会讨论了细胞计数方法对细胞活率结果的三种影响。第一,由于样本中存在红细胞(RBC)残留,明场成像和台盼蓝染色将对原代细胞样本的活率测量产生显著影响;第二,台盼蓝染料和染色时间会影响死亡和濒死的免疫细胞群;第三,基于液流系统的机械应力会在测量过程中改变细胞活率。
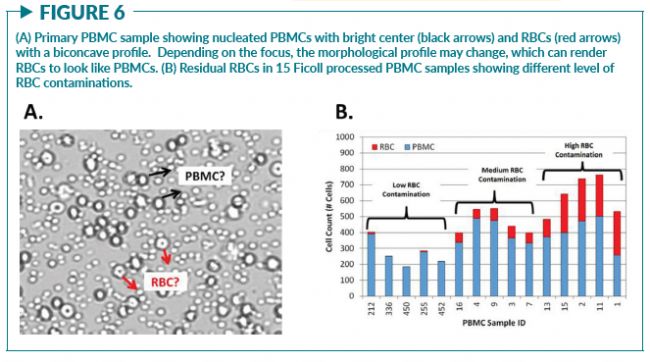
原代细胞通常是CTP的关键组成部分。测量单采血样本或PBMC等原代细胞时的主要问题之一是残留红细胞的存在。使用明场成像和台盼蓝染色直接对这些原代细胞样品进行计数可能会误将残留的红细胞也计数在内。由于红细胞在明场成像中也会显示为具有明亮中心的圆形物体,因此活细胞计数或细胞浓度可能会被高估,从而使计算出来的细胞活率百分比增加(图6A)。在Chan等人先前发表的文章中,发现样本中残留的红细胞浓度是有供体差异的,因此在计算活率时会产生很强的可变性(图6B)。为了提高原代细胞样本中活细胞计数的准确性,可以利用荧光核染色排除残留红细胞、血小板和细胞碎片的计数(图7)。荧光细胞核染料,如吖啶橙(AO)和碘化丙啶(PI)可以提高对活细胞和死细胞判断的准确性,从而提高活率计算的一致性 。
原代细胞通常是CTP的关键组成部分。测量单采血样本或PBMC等原代细胞时的主要问题之一是残留红细胞的存在。使用明场成像和台盼蓝染色直接对这些原代细胞样品进行计数可能会误将残留的红细胞也计数在内。由于红细胞在明场成像中也会显示为具有明亮中心的圆形物体,因此活细胞计数或细胞浓度可能会被高估,从而使计算出来的细胞活率百分比增加(图6A)。在Chan等人先前发表的文章中,发现样本中残留的红细胞浓度是有供体差异的,因此在计算活率时会产生很强的可变性(图6B)。为了提高原代细胞样本中活细胞计数的准确性,可以利用荧光核染色排除残留红细胞、血小板和细胞碎片的计数(图7)。荧光细胞核染料,如吖啶橙(AO)和碘化丙啶(PI)可以提高对活细胞和死细胞判断的准确性,从而提高活率计算的一致性 。

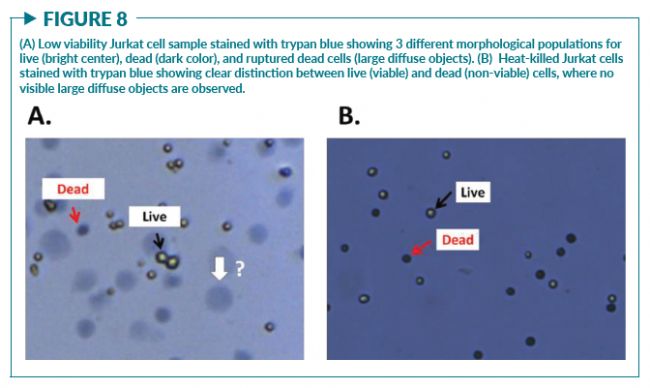
影响细胞活率计算的另一个因素是染料本身,特别是传统方法常使用的台盼蓝。在Chan等人的研究中发现,在用台盼蓝对低活率的Jurkat细胞和小鼠脾细胞进行染色后,观察到三个形态学上不同的群体:活细胞(明亮的中心),死细胞(深蓝色)和未知(大的弥散物体)(图8A)。后续的定量实验证明当细胞被台盼蓝染色时,死细胞的密度降低了。结果显示,AO/PI染色和台盼蓝染色测得的活细胞浓度是一致的;但是,台盼蓝测得的死细胞浓度要低得多。有趣的是,对热杀伤的Jurkat细胞样本染色时,未观察到较大的弥散物体(图8B)。在发现了这些弥散物体的存在之后,研究者进行了一项实验以确定弥散物体的起因和构成。在先前获得的视频中,发现这些弥散物体直接来源于与台盼蓝相互作用的死亡或濒死的免疫细胞(PBMC),证明有可能是染料的渗透作用裂解了细胞。该现象会使死细胞的数量被低估,从而高估细胞活率。实验证实PI不会引起与台盼蓝类似的细胞形态变化 。
前面两个例子表明由于活细胞计数和死细胞计数误差的影响而导致细胞活率计算存在可变性。还有其他因素可以直接影响实际的细胞活率,例如染料诱导的细胞毒性和机械应力诱导的细胞活率降低。Mascotti等人的研究(2000)表明,台盼蓝在大约十分钟后可诱导细胞死亡,导致细胞活率降低,而AO/PI染色方法显示了长达120分钟的活率稳定性。欧洲药典标准(2.7.29)关于 “有核细胞计数和活率” 的部分提示了在台盼蓝染色溶液中细胞孵育时间的重要性,并指出在数据采集之前,细胞样本不应在台盼蓝溶液中染色超过4分钟。因此,细胞样本的染色时间会极大地影响活率计算结果并在样本之间引入差异。
最后,在之前的报告中也观察到了仪器引起的对细胞活率的影响。在Chen等(2017)的研究中,作者描述了他们对机械应力诱导的细胞活率降低的观察和定量分析。作者发现,与基于液流的自动细胞计数仪一起使用时,磷酸盐缓冲盐水(PBS)作为稀释剂会使细胞活率降低,这一现象的原因是系统引入的机械剪切应力。此外,长时间将细胞样本孵育在PBS中也会使细胞活率降低。作者发现几种其他的稀释剂可以在长时间孵育中保持细胞样本的活率,并提供更加精确的细胞培养条件。
总而言之,能影响活细胞和死细胞计数的方法可以显著改变细胞活率的结果。重要的是要了解所选细胞计数方法的原理以及过程,包括细胞样本、细胞样本制备、细胞计数仪器、试剂、耗材和分析算法等,这些都会引起细胞计数和活率计算的变化。
通过控制策略提高活率测量的置信度
细胞活率测量的一般工作流程可以归纳为几个关键步骤:
- 1)取样;
- 2)样本制备;
- 3)数据收集;
- 4)数据处理与分析(图9)
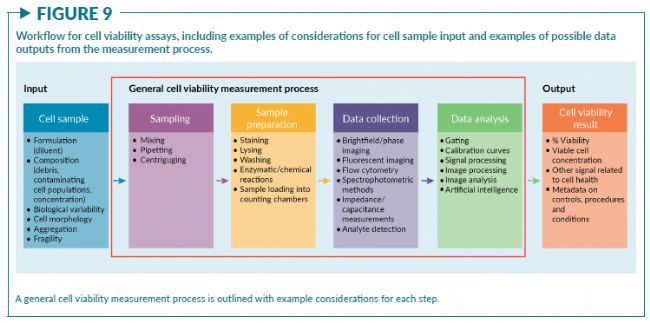
该过程中的每个步骤都会给测量结果带来差异。引起差异的来源和差异的水平取决于细胞样本的属性以及活率测量方法的类型。控制策略通常会在测量过程中的特定节点实施一种技巧性的操作,用于提高测量结果的置信度。
在研讨会上,NIST提出了几种正在开发中的控制策略,用以提高细胞活率测量,尤其是基于图像原理的活率测量的置信度。每种方法都建立了一种途径来应对由测量过程中特定节点引起的潜在变化,例如图像采集、分析和设门的步骤。通过这些研究,NIST展示了密切观察测量过程中每一步骤 (即从样本准备到最终分析)的重要性。这些节点都有可能为测量引入显著差异和误差。在这里,我们明确了细胞活率测量过程中每一步骤的潜在差异来源,并给出了NIST正在开发的控制策略的示例。
取样是细胞活力测量过程中的重要步骤。在此步骤中,通常会从较大体积的细胞中取样一小部分细胞。如果在此步骤中混匀和移液的操作不当,则用于活率测量的测试样本可能无法代表原本大体积的样本,从而破坏了活率测量的相关性。如果细胞样本中存在聚团,则可能会影响取样,就需要在样本制备和数据分析过程中增加其他步骤以解决聚团问题。在这些情况下,控制样本中的细胞聚团很重要,而且监测聚团细胞百分比可以提示使用者注意测量条件是否存在问题。在采样步骤中应考虑环境因素,例如温度和湿度以及样本的聚集特性。
样本制备是引起测量差异的另一个重要来源,由于涉及许多手动步骤,通常难以控制。在一些情况下,可以通过自动液体工作站处理样本(自动化可以集成到数据采集设备中或者是外部独立的液体处理器)来控制样本制备,或者通过遵循详细的样本制备SOP进行控制。此外,试剂和耗材(例如计数板)也会影响测量质量。样本制备还可能引起样品属性的变化。任何导致细胞死亡的样本制备步骤对于活率测量尤其成问题,应进行控制以在整个测量过程中保持样本的稳定性。
数据采集和期间使用的仪器通常是细胞活率测量过程中的黑匣子,特别是当数据采集是自动化或半自动化的情况下。差异来源的控制策略有时是内置在仪器和数据采集流程中的;然而与任何自动化系统一样,错误可能直到测量值超出预期范围时才被发现(此时,超过预期范围是由于测量误差还是细胞样本真实的生物学现象导致尚不清楚)。常规的仪器验证和维护可以帮助减少数据采集中的错误;然而,确保每一个样本都被正确分析仍然是一项挑战。采纳测量中过程控制可以帮助在活率分析过程中验证测量条件。例如,在基于图像的台盼蓝细胞活率测量中,图像质量,特别是聚焦和图像亮度会影响细胞活率测量。在运用自动图像分析算法之前,图像必须达到足够高的质量,这一点至关重要。
NIST演示了一种将少量微珠掺入细胞样品中的方法,以便在基于细胞计数板的成像细胞活率分析仪(Cellometer Auto 2000,Nexcelom)中进行分析。其中微珠作为独立于真实细胞样本的人工制品,用于监控图像质量。微珠对图像聚焦变化很敏感,研究人员利用采集的数据表征了微珠的特征与图像聚焦和亮度之间的关系。在后续细胞活率测量中,微珠可用于寻找一个参考聚焦平面;使用者可借助一种开发出来的工具在每次测量时根据微珠的特征返回到参考的聚焦平面。这种方法提高了从0%活率到接近100%活率的Jurkat细胞样品中基于台盼蓝自动活率测量的可重复性,并且提高了以人工细胞计数为参照的测量准确性。
在研讨会上,NIST提出了几种正在开发中的控制策略,用以提高细胞活率测量,尤其是基于图像原理的活率测量的置信度。每种方法都建立了一种途径来应对由测量过程中特定节点引起的潜在变化,例如图像采集、分析和设门的步骤。通过这些研究,NIST展示了密切观察测量过程中每一步骤 (即从样本准备到最终分析)的重要性。这些节点都有可能为测量引入显著差异和误差。在这里,我们明确了细胞活率测量过程中每一步骤的潜在差异来源,并给出了NIST正在开发的控制策略的示例。
取样是细胞活力测量过程中的重要步骤。在此步骤中,通常会从较大体积的细胞中取样一小部分细胞。如果在此步骤中混匀和移液的操作不当,则用于活率测量的测试样本可能无法代表原本大体积的样本,从而破坏了活率测量的相关性。如果细胞样本中存在聚团,则可能会影响取样,就需要在样本制备和数据分析过程中增加其他步骤以解决聚团问题。在这些情况下,控制样本中的细胞聚团很重要,而且监测聚团细胞百分比可以提示使用者注意测量条件是否存在问题。在采样步骤中应考虑环境因素,例如温度和湿度以及样本的聚集特性。
样本制备是引起测量差异的另一个重要来源,由于涉及许多手动步骤,通常难以控制。在一些情况下,可以通过自动液体工作站处理样本(自动化可以集成到数据采集设备中或者是外部独立的液体处理器)来控制样本制备,或者通过遵循详细的样本制备SOP进行控制。此外,试剂和耗材(例如计数板)也会影响测量质量。样本制备还可能引起样品属性的变化。任何导致细胞死亡的样本制备步骤对于活率测量尤其成问题,应进行控制以在整个测量过程中保持样本的稳定性。
数据采集和期间使用的仪器通常是细胞活率测量过程中的黑匣子,特别是当数据采集是自动化或半自动化的情况下。差异来源的控制策略有时是内置在仪器和数据采集流程中的;然而与任何自动化系统一样,错误可能直到测量值超出预期范围时才被发现(此时,超过预期范围是由于测量误差还是细胞样本真实的生物学现象导致尚不清楚)。常规的仪器验证和维护可以帮助减少数据采集中的错误;然而,确保每一个样本都被正确分析仍然是一项挑战。采纳测量中过程控制可以帮助在活率分析过程中验证测量条件。例如,在基于图像的台盼蓝细胞活率测量中,图像质量,特别是聚焦和图像亮度会影响细胞活率测量。在运用自动图像分析算法之前,图像必须达到足够高的质量,这一点至关重要。
NIST演示了一种将少量微珠掺入细胞样品中的方法,以便在基于细胞计数板的成像细胞活率分析仪(Cellometer Auto 2000,Nexcelom)中进行分析。其中微珠作为独立于真实细胞样本的人工制品,用于监控图像质量。微珠对图像聚焦变化很敏感,研究人员利用采集的数据表征了微珠的特征与图像聚焦和亮度之间的关系。在后续细胞活率测量中,微珠可用于寻找一个参考聚焦平面;使用者可借助一种开发出来的工具在每次测量时根据微珠的特征返回到参考的聚焦平面。这种方法提高了从0%活率到接近100%活率的Jurkat细胞样品中基于台盼蓝自动活率测量的可重复性,并且提高了以人工细胞计数为参照的测量准确性。
细胞活率测量的对照材料
对照材料,如商品化的参考微珠和实验室制备的固定死细胞样本,可用于建立细胞活率测量中的控制策略。根据选择的测量方法,这些材料会有非常具体的应用。参考微珠的优点是稳定性好,可以在市场上买到,而且在不同实验室之间可以保证品质的均一。微珠材料可用于建立仪器验证方法,或者如前所述,用于在测量过程中对测量质量进行的基准化分析。模拟细胞属性(例如散射性和染色特性)的新型合成参考材料也可以用作测量过程控制,以解决由过程(例如细胞染色)和数据分析(例如细胞设门)引起的差异性来源。
固定细胞材料也可以作为一种方便的工具来模拟样本的特定属性,如流式细胞术中的散射特性或成像方法中的染色特性。细胞可以保留特定的细胞特征,如形态和表面标记物。对于基于细胞核染色的活率分析方法,固定细胞尤其有吸引力,因为固定可以保存细胞的核物质,并使其可用于评估膜的渗透性。由于固定细胞的许多特性可能与测试细胞非常相似,也许可以与目标细胞相同的方式对它们进行采样、染色、处理和测量。在实用性方面,固定细胞材料可以大批量生产,并有可能储存很长时间。
死亡和濒死细胞材料是细胞活率测量的一类重要生物参考材料。死细胞或濒死细胞的外参研究(即恢复研究)对于评估细胞活率测量的特异性、线性和灵敏度至关重要。有多种方法可用来获得死亡或濒死细胞材料,包括热休克、固定、受限的环境生长条件、营养剥夺和化学处理。这些材料通常是临时制备的,因为它们可能不具备长期存储所需的稳定性。重要的是,用于杀死或损伤细胞的不同方法会导致死细胞的不同属性。例如,一些杀伤方法可能会造成更多的细胞碎片,而另一些方法可能会使细胞失去活性,但仍然保持相当的完整性和均匀性。值得注意的是,对照材料的属性范围应该与待测细胞样本的属性范围一致。例如,如果需要在生物制造过程的特定步骤中分析细胞活率,则可以根据细胞在此过程的上一步中可能遇到的干扰类型(例如流体应力、环境条件、或营养状况)来确定对照物质。即使在特定CTP的制造过程中,也尚未有任何一类参考物质被认证可充分代表用于活率测量的各种类型的细胞样本。实验室制备死亡或濒死细胞控制材料的最佳方案和指导原则将有助于支持细胞活率测量控制策略的实施。
固定细胞材料也可以作为一种方便的工具来模拟样本的特定属性,如流式细胞术中的散射特性或成像方法中的染色特性。细胞可以保留特定的细胞特征,如形态和表面标记物。对于基于细胞核染色的活率分析方法,固定细胞尤其有吸引力,因为固定可以保存细胞的核物质,并使其可用于评估膜的渗透性。由于固定细胞的许多特性可能与测试细胞非常相似,也许可以与目标细胞相同的方式对它们进行采样、染色、处理和测量。在实用性方面,固定细胞材料可以大批量生产,并有可能储存很长时间。
死亡和濒死细胞材料是细胞活率测量的一类重要生物参考材料。死细胞或濒死细胞的外参研究(即恢复研究)对于评估细胞活率测量的特异性、线性和灵敏度至关重要。有多种方法可用来获得死亡或濒死细胞材料,包括热休克、固定、受限的环境生长条件、营养剥夺和化学处理。这些材料通常是临时制备的,因为它们可能不具备长期存储所需的稳定性。重要的是,用于杀死或损伤细胞的不同方法会导致死细胞的不同属性。例如,一些杀伤方法可能会造成更多的细胞碎片,而另一些方法可能会使细胞失去活性,但仍然保持相当的完整性和均匀性。值得注意的是,对照材料的属性范围应该与待测细胞样本的属性范围一致。例如,如果需要在生物制造过程的特定步骤中分析细胞活率,则可以根据细胞在此过程的上一步中可能遇到的干扰类型(例如流体应力、环境条件、或营养状况)来确定对照物质。即使在特定CTP的制造过程中,也尚未有任何一类参考物质被认证可充分代表用于活率测量的各种类型的细胞样本。实验室制备死亡或濒死细胞控制材料的最佳方案和指导原则将有助于支持细胞活率测量控制策略的实施。
细胞活率测量标准的开发
如前所述,许多研讨会的参与者都表达了制定细胞活率标准的需求。最近发布的ISO 20391细胞计数标准系列中已涉及细胞活率,并且在一些领域、仪器或特定细胞类型方面的细胞计数和活率标准已经存在或正在开发中。例如,ASTM最近致力于开发一种测量支架中细胞活率的测量方法(ASTM WK62115,“测量支架中细胞活力的新测量方法”)。在国际标准组织 (ISO) 生物技术委员会(TC)的ISO TC 276中,分析方法工作组正处于完成有关细胞治疗产品(CTP)表征和测试的标准的最后阶段,“ ISO / DIS 23033生物技术-分析方法-表征和检测细胞治疗产品的一般准则”。该标准将细胞活率确定为CTP检测中非常重要的质量属性,并建立了对最终CTP中细胞活率测量的要求。该标准还提供了适用于选择和开发用于CTP表征和检测的分析方法的通用指南,以及方法确认和验证的注意事项和要求;但是,它没有为细胞活率的测量提供具体参考。
目前,还没有形成统一的标准用以制定细胞活率相关的术语,和指导fit-for-purpose的细胞活率测量方法的开发。一个更通用的,可以兼顾fit-for-purpose考量和最佳可行性方案的细胞活率测量标准将能够满足相关人员的需求,也将最适合于涉及到广泛用途和细胞类型的CTP行业。细胞活率的通用标准需要明确细胞活率的定义和活率结果报告的相关术语。细胞活率的结果报告应包含测量使用的方法和所测生物指标的信息。例如,当报告一个细胞样本的活率为70%时,需附加更具体的信息(比如用基于成像分析原理的台盼蓝排除法测得)。只有明确了所使用的测量方法,细胞活率结果之间才具有可比性,也才可将结果用于合适的用途。
通用标准还应能解决与细胞样本相关的常见挑战,包括诸如细胞群体异质性,样本稳定性以及污染碎片和细胞类型等。这些属性都有可能对活率测量方法产生影响。通用标准需要明确的另一个关键方面是测量控制策略,包括控制材料的适当使用和制备,以及用于验证所选测量过程的方法,这是需要相关人员进一步考虑的重要领域。使用不同仪器和原理(例如基于流式细胞仪、成像、电阻抗、代谢物的测定等)测量细胞活率的一般考虑因素也需要被共享。此外,通用标准应包含如何比较不同活率测量方法,以及如何评估所选方法的适用性的实验框架和指导原则。
目前,还没有形成统一的标准用以制定细胞活率相关的术语,和指导fit-for-purpose的细胞活率测量方法的开发。一个更通用的,可以兼顾fit-for-purpose考量和最佳可行性方案的细胞活率测量标准将能够满足相关人员的需求,也将最适合于涉及到广泛用途和细胞类型的CTP行业。细胞活率的通用标准需要明确细胞活率的定义和活率结果报告的相关术语。细胞活率的结果报告应包含测量使用的方法和所测生物指标的信息。例如,当报告一个细胞样本的活率为70%时,需附加更具体的信息(比如用基于成像分析原理的台盼蓝排除法测得)。只有明确了所使用的测量方法,细胞活率结果之间才具有可比性,也才可将结果用于合适的用途。
通用标准还应能解决与细胞样本相关的常见挑战,包括诸如细胞群体异质性,样本稳定性以及污染碎片和细胞类型等。这些属性都有可能对活率测量方法产生影响。通用标准需要明确的另一个关键方面是测量控制策略,包括控制材料的适当使用和制备,以及用于验证所选测量过程的方法,这是需要相关人员进一步考虑的重要领域。使用不同仪器和原理(例如基于流式细胞仪、成像、电阻抗、代谢物的测定等)测量细胞活率的一般考虑因素也需要被共享。此外,通用标准应包含如何比较不同活率测量方法,以及如何评估所选方法的适用性的实验框架和指导原则。
结语
随着近年CTP在提供挽救生命的治疗方面的成功,合适和可靠的细胞活率测量变得至关重要。本次研讨会将工业界、学术和政府实验室的相关人员聚集在一起,共同探讨了当前CTP活率测量领域面临的挑战,和提高活率测量的置信度的可能方法。研讨会参与者确定了fit-for-purpose的细胞活率方法开发的关键考虑因素,如样本属性、测量方法,以及用于识别活细胞和死细胞的生物指标的选择。重要的是,样本属性和许多测量过程的步骤之间会发生相互作用,这些作用在开发准确的、能反映样本真实状态的分析方法时是必须着重考虑的。研讨会上的一项重要共识是需要确定fit-for-purpose的测量方法,这些方法将为细胞的既定用途提供最相关的活率信息。细胞活率结果报告应包含测量方法以及计算公式的描述。此外,对照材料和对照研究的应用被证明具有提高细胞活率测量置信度的潜力。一套支持选择、开发和验证fit-for-purpose的细胞活率测量方法的标准将有助于加速CTP的开发。





