阿尔茨海默病的危险因素年龄、APOE基因型和性别驱动不同的分子途径

Neuron上发表一篇通过转录组学和代谢组学研究阿尔茨海默病(AD)的三个主要危险因素:年龄、APOE基因型和性别之间的相互作用。
研究中全面地分析人类APOE2、APOE3和APOE4靶向替代小鼠的转录组和血液代谢组。结果发现年龄对Trem2和Tyrobp领导的免疫模块所强调的大脑转录的影响最大,而APOE4与多个Serpina3基因的上调有关。重要的是,这些网络和基因表达变化在人脑中大多是保守的。最后,观察到年龄、APOE基因型和性别在未折叠蛋白反应途径上的显著相互作用。在外围,APOE2驱动不同的血液代谢体谱,突出的上调脂质代谢物。研究中确定了AD危险因素的单独和相互作用的分子途径,为阿尔茨海默病的研究提供了宝贵的资源。
- 不同APOE基因型、年龄和性别的小鼠模型脑和血清样本的分析策略
文中分析了3、12和24个月龄的雄性和雌性apoE2-TR、apoE3-TR 和apoE4-TR小鼠的大脑皮层转录组学和血清代谢组学。分析包括18种不同的实验条件(每种条件=7-8只小鼠)的转录和代谢组学。首先研究了APOE基因型、年龄、性别及其相互作用如何导致转录组学和代谢组学图谱的变化。
有趣的是,年龄是大脑转录的最重要因素(图 1A),APOE基因型对血清代谢组的影响最大(图1C)。主成分分析(PCA)显示,3个月的脑样本与12个月和老年24个月的脑样本显著分离。PCA中性别的分离也很显著。在血清样本中,apoE2-TR小鼠与其他apoE-TR小鼠之间观察到明显的分离(图1D)。
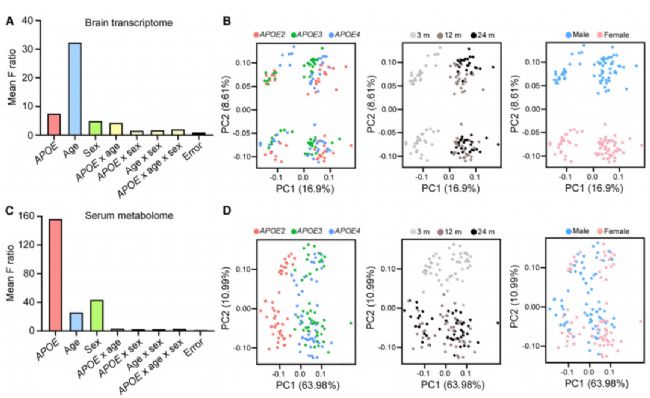 图1
图1
- 小鼠脑中与APOE基因型、年龄和性别相关的基因模块的鉴定
加权基因共表达网络分析结果显示四个模块与APOE基因型显著相关。与APOE2 或APOE3基因型相比,有两个模块上调 (Lightcyan和tan),两个模块下调(图2A)。十个模块与年龄显著相关,包括八个上调模块和两个下调模块(图2A)。其中一个模块洋红与性别显著相关,与男性相比,女性被上调(图2A)。
对与APOE基因型相关的模块进行了功能注释,并在每个模块中确定了前10个模块内枢纽基因。在lightcyan模块中的前10个枢纽基因主要来自Serpina3基因家族,包括Serpina3c、Serpina3f、Serpina3k、Serpina3l-ps、Serpina3m和Serpina3n(图2D)。该模块中的基因被富集,以调节内肽酶抑制剂的活性(图2E)。与APOE2或APOE3基因型相比,APOE4中的LightCyan模块Eigengene(ME)上调(图2F)。进一步研究了与老化相关的模块。蓝色模块与年龄显著相关,在12个月和24个月时上调(图2I)。该模块中的基因被富集到与细胞外囊泡(EVS)有关的过程中)(图2H)。已知在EVS中检测到该模块中的顶级枢纽基因,包括Anln、 Arhgef10 、 B3galt5、Csrp1、Endod1、Plekhb1和Zcchc24(图2G)。此外,粉红色模块也与衰老显著相关,与3个月和12个月相比,24个月的衰老被上调(图2L)。该模块中的基因被富集用于免疫应答(图2K),具有顶级枢纽基因,包括Trem2、Tyrobp和CD68,所有这些都涉及大脑中的小胶质细胞功能和免疫反应。
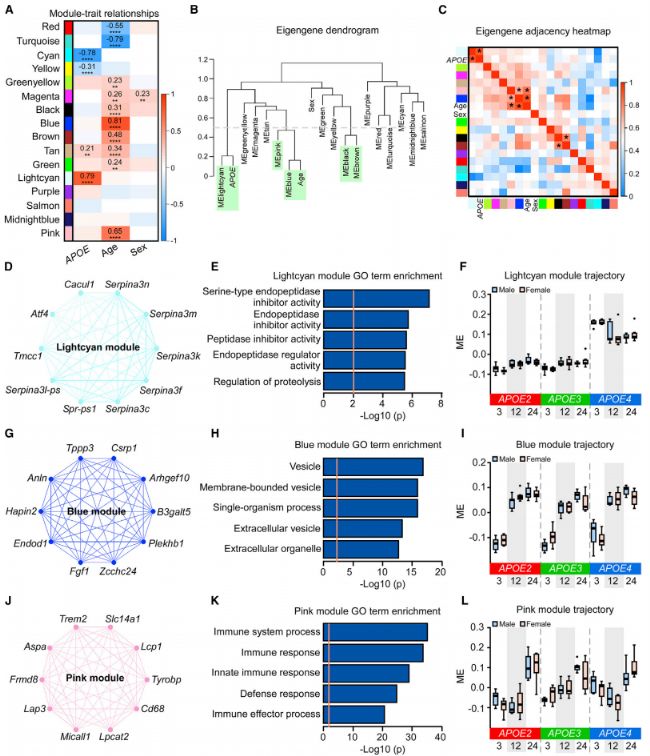 图2
图2
- 小鼠脑中APOE基因型、年龄、性别相关差异表达基因及通路的鉴定
在1,813个基因中观察三个APOE基因型之间的差异表达。受APOE基因型影响的DEGS显著富集于白细胞介素-7(IL-7)信号、5-羟色胺受体信号、GP6信号和eicosanoid信号通路(图3E)。在12个月与3个月,或24个月与3个月之间,约有3000个DEGS被发现,而24个月至12个月之间的DEGS数量低于500,这表明大脑转录的最显著变化出现在3至12个月的年龄(图 3F-3H)。受年龄影响的DEGS在Ephrin受体信号等途径中显著富集(图3J)。与性别相关的DEGS在雄激素信号、拉诺醇生物合成和突触长期抑制等途径中显著富集(图3M)。前10位DEGS的分层聚类没有成功地根据性别分离样本(图3L),表明这些基因也可能受到年龄或APOE基因型等其他因素的调控。
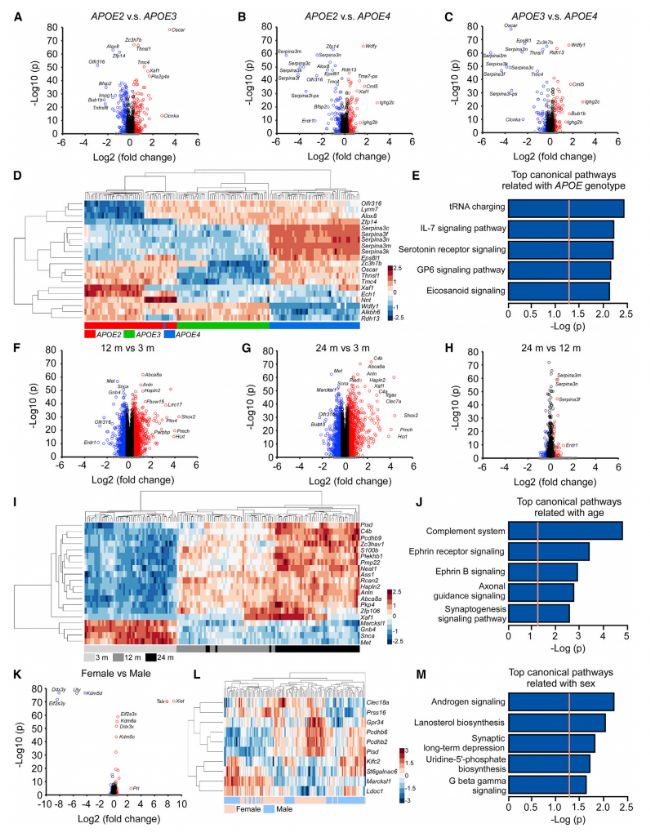 图3
图3
- 小鼠血清中与APOE基因型、年龄和性别相关的代谢物模块的鉴定
血清代谢物的WGCNA分析确定了五个共表达代谢物模块(图4A)。表明APOE2通过上调脂质代谢来驱动不同的血清代谢组学特征。此外,黄色和绿色模块也与性别显著相关,女性的表达低于男性(4D-4G)。进一步研究了与年龄显著相关的模块,结果表明,衰老对血清代谢组学的影响是氨基酸和生物胺的下调和酰基肉碱特别是长链脂肪酸的上调。
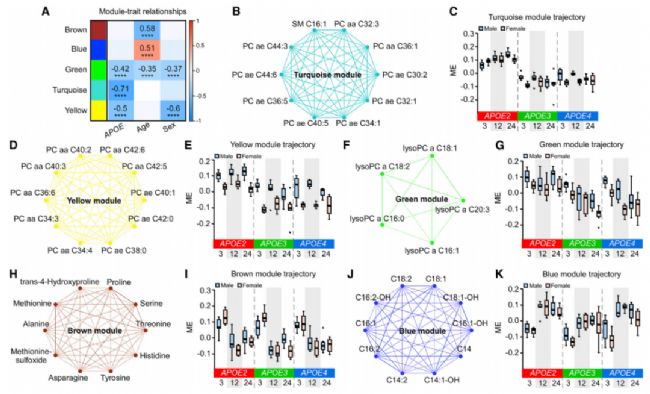 图4
图4
- APOE基因型、年龄和性别相关差异表达代谢物的鉴定
在三种APOE基因型中共筛选出130个DEM。(图5A-5C)。在对年龄的研究中,前20个DEM的层次聚类成功地将3个月的血清样本与12个月和24个月的血清样本分离,主要是氨基酸和生物胺的下调和3个月后酰基肉碱的上调(图5H-5K)。在对性别的研究中,前20个DEM都是脂类,但这些DEM的层次聚类并没有明确区分性别。
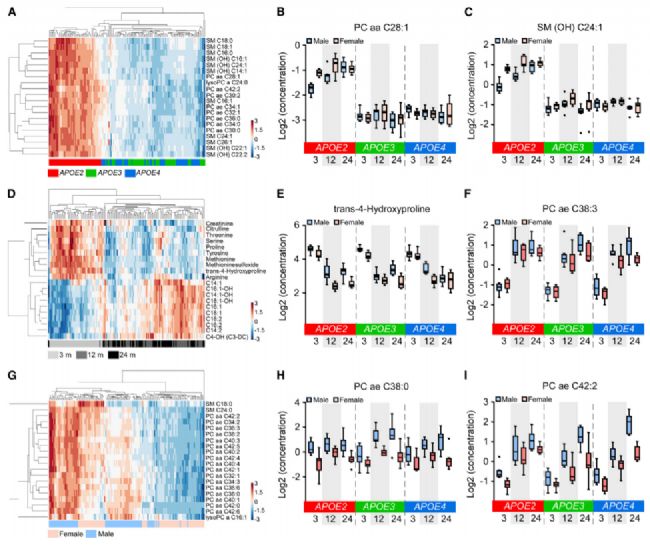 图5
图5
- 结果
文中详细研究了APOE基因型对脂质代谢和相关途径的影响,全面了解APOE基因型对AD的影响,为建立基于机制的治疗提供了理论依据。性别对血清代谢组学的影响在研究中并不突出,可能是由于年龄和APOE基因型的优势效应掩盖了性别效应。总之,综合数据分析了AD三大风险因素背后的分子途径,并明确他们如何共同驱动AD的产生。这些结果为治疗AD提供了理论依据,并将促进模型系统和人类疾病的发现和验证研究。
原文下载链接:
https://pan.baidu.com/s/1KO9m2OJPWc24gNhZZyxmmg
提取码:flzc
复制这段内容后打开百度网盘手机App,操作更方便哦





