抗体药NMPA、FDA申报政策与审查制度
任何抗体药物在上市前都必须要在美国食品及药品管理局(FDA:Food and Drug Administration)申报并且获批后才能够上市,在我国上市前还需要国家药品监督管理局(NMPA:National Medical Products Administration)的审批。无论是NMPA还是FDA的审批都是十分严格的,不熟悉政策的话很可能延长审批时间,那么今天就和小编一起了解一下NMPA、FDA申报的政策吧。
抗体药现状
近年来抗体类药物凭借特异性强、副作用小等优势在肿瘤和自身免疫性疾病治疗等领域取得了快速发展.
1986 年 FDA 批准了第一个治疗性单抗药物,单抗药物从靶点发现到人源化抗体技术改进, 从临床研究的不断推进到商业化策略的不断完善,各方面均日趋成熟,已然占领了医药领域市场的半壁江山。全球单抗药物市场规模约千亿美元,近10年的增长速度仍保持 10% 以上,高于其他医药行业 5% ~ 6%的增速水平。众所周知,美国无论研发水平或市场份额,均为全球单抗药物研发最大的基地,近年来,随着中国医药市场及政策的日趋成熟,中国成为仅次于美国的第二大单抗药物市场。数据来自科睿唯安( Clarivate Analytics, 原汤森路透知识产权与科技事业部) 的 Cortellis 数据库作为检索对象 (图1,2)截止2018年10月[1]。
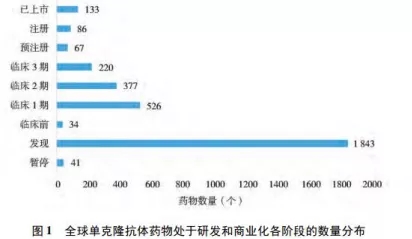
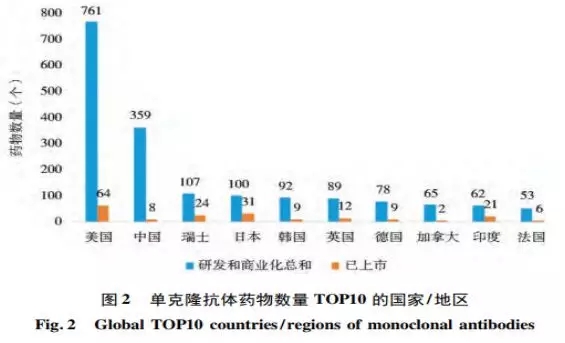
抗体药有其独特性——研发周期长、投入成本高、成功率低。而创新药从研发到上市一般用时均在10年以上,研发至少需要投入10-50亿美元,从临床实验的推进到最终能够获批上市的成功率仅仅为5%-17%[2]。
抗体药主要适应症为恶性肿瘤的治疗,与小分子靶向药相比,抗体药的临床疗效好、见效快且副作用小[1]。近年来,随着医学发展,抗体药以单抗单用,单抗联用,双抗单用及抗体偶联药物类药物等为主要发展趋势。
申报审查流程
药品是特殊的商品,药品的研制、开发、生产、销售、进口等均须通过严格的审批和审查,由此才形成了各国的药品注册制度。但是不同国家对药品注册的要求各不相同,每个阶段耗时有很大差异,一般来说新药研发申请审批流程包括研发阶段,IND申报审批阶段,药物临床试验Ⅰ期,Ⅱ期,Ⅲ期,NDA/BLA上市申请审批及临床Ⅳ期阶段。
通常对于临床前和临床研究的时间变动很小,而临床试验的申报、审批与新药注册的申请、审批的决定权在各国的药品监管部门,其工作开展的效率是药物上市速度的决定因素之一。
2017年底食药监总局发文,《总局关于鼓励药品创新被告优先审评审批的意见》对申请人在美国、欧盟同步申请并获准开展药物临床试验的新药临床试验申请实行优先审评审批。2018年7月,NMPA发布《国家药品监督管理局关于调整药物临床试验审评审批程序的公告》,称在我国申报药物IND,自申请受理并缴费之日起60个工作日内,若未收到否定或质疑意见的,可按照提交方案开展临床试验,而FDA仅为30个自然日,除此之外,因为美国在创新药方面的科研水平及经验相对丰富,若FDA对于新药IND阶段有一些建议,则会有助于企业的改进,若FDA通过了新药IND审批,则对于企业在中国的IND申批及与CDE等监管机构的沟通有非常大的帮助,很大机率会加速IND审批[3]。
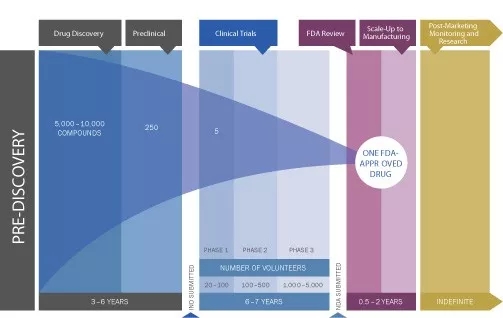
图片来源[4]
国内外政策形势
为促进世界各国制药工业界与药品监管部门的沟通协调,旨在使最安全、有效、高质量的药品以最经济、快捷的方式得到批准和上市,因此,1990年由美国、日本和欧盟三方的药品监管部门和制药行业建立了ICH,制定了统一的标准规范。ICH是International Conference on Harmonisation of TechnicalRequirements for Registration of Pharmaceuticals for Human Use(人用药品注册技术要求国际协调会)的简称。
ICH旨在制定标准及统一的规范,以保证质量(Quality,Q)、确保安全性(Safety,S)和有效性(Efficacy,E)三个方面制定的各类技术要求作为药品能否批准上市的标准,使药品以最经济、快捷的方式得到批准和上市。
2017年6月1日,CFDA成为ICH正式成员。2018年6月7日,NMPA成为ICH管理委员会成员。随着成为ICH管理委员会成员,NMPA的法规加速与ICH接轨。2019年7月19日和9月30日,CDE分别发布了关于对29个ICH三级指导原则、15个ICH Q系列指导原则转化实施建议公开征求意见的通知。国内企业将直面创新药全球开发的激烈竞争。
优化流程,加速上市
随着中国成为ICH管理委员会成员,NMPA的法规逐渐与ICH接轨,技术指导原则等也越来越向其靠拢,国内生物制药企业想要分得一杯羹,将与全球药企展开激烈竞争。近年来,CDE进行了一系列改革并快速与国际靠拢,使越来越多企业选择中美双报或多国多报,从而加速药品上市。而在审评的过程中,其他国家对中国数据的接受问题,一直是最为关注的焦点之一。其中,以中美双报创新药最为引人关注。中美双报不应该把一个新药的资料做成两套分别报送给FDA和NMPA,而是应该在ICH的指导原则的基础上尽可能同时满足两国的法规要求。
因此,在药品立项时,应全考虑所申报国家的药品审批情况,竞争性药品、市场容量、开发周期及难度。同时,为产品的开发提速应尽可能利用各种加速审评机制[3]。
加入ICH对中国的监管部门及各方面提出更高的要求,我国的药品审批审评制度改革,也能够更好地推动创新药物的研发,同时,不同国家之间也能够相互认可以ICH为标准的研究数据,从而更有利于中国企业在全球市场的竞争力,进一步提高中国药品研发的速度和质量。
ICH成立专家工作组,其认为电子通讯和术语的统一,应作为互读文件的基础,因此把难以列入质量、安全和有效性的课题,设为综合类,以M(Multidisciplinary) 表示,同时,成立了若干子课题,使新药申报的格式和内容趋于一致,制定了通用技术文档(CommonTechnical Document, CTD),为M4。eCTD即电子通用技术文档(electronic Common Technical Document),是电子化的CTD注册申报方式,相对于传统的纸质递交,eCTD,更便捷、更环保。对审评者来说,eCTD格式可以对药品资料进行全生命周期管理,对申报材料的传输、审评及归档十分便捷,eCTD格式同时也利于各个国家和地区的药监部门的审评交流,对于申请者来说,单一药品如需同时多国递交,M2~M5的资料可以共享,大大降低了成本并提高了效率。
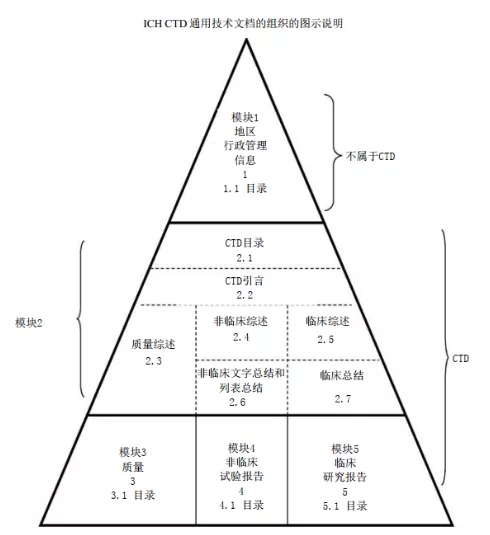
FDA要求从2017年05月05日:必须使用eCTD格式提交新药申请(NDAs),仿制药NDA(ANDA)和生物制剂许可申请(BLA)。2018年5月5日,研究性新药申请(IND)和主文件必须使用eCTD格式提交[5]。
NMPA在2017年11月31日试行《生物制品注册分类及申报资料要求》中详细阐述了单克隆抗体的分类及申报资料条目。2018年2月1日起,《总局关于适用国际人用药品注册技术协调会二级指导原则的公告(2018年第10号)》规定,化学药品注册分类1类、5.1类以及治疗用生物制品1类和预防用生物制品1类注册申请适用《M4:人用药物注册申请通用技术文档(CTD)》。其中,《M4:人用药物注册申请通用技术文档(CTD)》包括《M4(R4):人用药物注册申请通用技术文档的组织》《人用药物注册通用技术文档:行政管理信息》《M4Q(R1):人用药物注册通用技术文档:药学部分》《M4S(R2):人用药物注册通用技术文档:安全性部分》和《M4E(R2):人用药物注册通用技术文档:有效性部分》[6]。
2019年08月26日,《药品管理法》经第十三届全国人民代表常务委员会第十二次会议审议通过,同时,国家药品监督管理局组织起草了《药品注册管理办法(征求意见稿)》《药品生产监督管理办法(征求意见稿)》《药品经营监督管理办法(征求意见稿)《药品经营监督管理办法(征求意见稿)》,于2019年09月30日向社会公开征求意见[7]。2019年09月17日,CDE为加快药品审评审批信息化建设,推进药品按照要求进行申报和受理,发布了《eCTD申报指南(征求意见稿)》,正式实施将指日可待。
随着《药品管理法》自2019年12月01日起正式施行,即将改变整个中国药品的注册审批格局。相信在不久的将来,随着ICH成员国的政策法规的统一,国际多中心开展临床试验被接受,eCTD申报格式的普及,将大大加快药品审批进度,造福更多患者。
参考文献:
[1]全球单克隆抗体药物研发现状及发展趋势[J].高倩,江洪,叶茂,郭文娟.中国生物工程杂志 2019,39(3):111-119
[2]产业观察:创新药研发步入快车道,以中国速度助力全球医药创新新浪财经[N].
[3]中美双报重点从IND扩展至NDA [N] 原创:刘卉.医药经济报,2019.07.15日
[4]]http://blogs.nature.com/news/2012/09/pharma-comes-together-over-clinical-trials.html
[5]https://www.fda.gov/drugs/electronic-regulatory-submission-and-review/electronic-common-technical-document-ectd
[6]http://samr.cfda.gov.cn/WS01/CL0087/223345.html
[7]http://www.moj.gov.cn/government_public/content/2019-10/15/657_3234024.html

扫码关注百奥赛图了解更多资讯哦





