RNA 完整值(RIN) — RNA 质量控制标准化
摘要
评估 RNA 完整性是获得有意义基因表达数据的第一个关键步骤。微阵列或 Qrt-pcr 实验能否成功主要取决于 RNA 是否完整。Agilent 2100 生物分析仪系统和 RNA 试剂盒在协助研究者确定 RNA 质量方面发挥重要作用。Agilent 2100 生物分析仪系统上生成的谱图包括浓度信息,允许直观检查 RNA 完整性,并生成核糖体比率。本应用简报描述的新软件算法开发用于从生物分析仪电泳图提取 RNA 样品完整性的信息。
前言
确定 RNA 起始材料的完整性是基因表达分析中的一个关键步骤。Agilent 2100 生物分析仪系统及相关的 RNA 6000 Nano 试剂盒和 Pico 试剂盒已成为 RNA 质量评估和定量的标准[1,2]。在精密加工的芯片上利用电泳分离,分离 RNA 样品,并通过激光诱导荧光检测法检测。通过生物分析仪软件可显示图像如电泳图和凝胶图以及多种分析结果如样品浓度和核糖体比率。电泳图提供了 RNA 样品质量的详细直观评估结果。然而,依赖肉眼观察解释数据的方法本身存在缺陷。此前,研究者们已将核糖体比率作为特征值应用在生物分析仪软件中,用来表征凝胶分析中 RNA 的完整性。然而,仅通过总 RNA 的核糖体比率去评估 RNA 完整性通常不准确[3]。通过显示 RNA 片段大小分布的详细画面,Agilent 2100 生物分析仪系统提供更好的 RNA 完整性评估结果。

RNA 降解是一个逐渐的过程。随着降解推进(图 1),18S/28S 核糖体条带比减小,而两个核糖体峰和下位内标之间的基线信号增大。生物分析仪软件自动生成 18S/28S 核糖体亚基的比率。尽管核糖体比率在确定凝胶电泳中样品降解程度方面发挥重要作用,但 Agilent 2100 生物分析仪系统中更详细的分析表明, 该比率未充分描述样品完整性。
为了将 RNA 完整性解释过程标准化, 安捷伦科技有限公司已经推出一种新的 RNA 质量评估工具。开发 RNA 完整值(RIN)从整体电泳图出发,以消除 RNA 质量控制中的个人解释。它将完整电泳图纳入考量。基于 1 至 10 的编号系统,RIN 软件算法可将真核生物总 RNA 分类,其中 1 代表降解最严重的情况并且 10 代表最完整。通过这种方式,有助于解释电泳图,令样品比较成为可能,并确保实验的重复性。
RIN 工具的开发
RIN 软件算法针对 Agilent 2100 生物分析仪系统中用真核生物总 RNA Nano 分析法采集的样品开发。输入数据包括来自三个哺乳动物物种(人类、小鼠和大鼠)的不同组织中约 1300 份总 RNA 样品,所有样品的完整程度各不相同。RNA 样品的分类由应用专家手动进行,他们将每份总 RNA 样品分类至 1-10 的预定编号系统。图 2 展示了不同 RIN 类别的代表性电泳图(编号分别为10、6、3、2)。

图2
用于调试 RNA 完整值(RIN) 软件的样品电泳图。样品为完整样品(RIN 10) 至降解样品(RIN 2)
为开发 RIN 算法,采用了神经网络等自适应学习工具(工具由Quantiom Bioinformatics 提供)。这些工具允许确定可以从电泳图提取的关键特征。这些特征值采用的是电泳图的组成部分如信号峰面积,强度,比值等。图 3 中列出电泳图的重要要素。他们包括不同的区域(前区、5S区、快速区、中区、前体区、后区)和峰(标准品、18S、28S)。
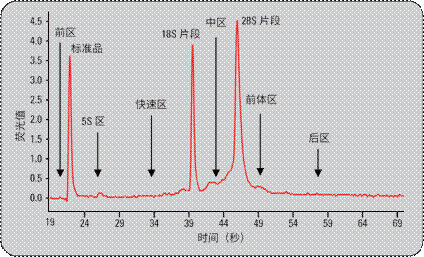
图 3
详述提示RNA 质量的各区域的电泳图
评估 RNA 完整性是获得有意义基因表达数据的第一个关键步骤。微阵列或 Qrt-pcr 实验能否成功主要取决于 RNA 是否完整。Agilent 2100 生物分析仪系统和 RNA 试剂盒在协助研究者确定 RNA 质量方面发挥重要作用。Agilent 2100 生物分析仪系统上生成的谱图包括浓度信息,允许直观检查 RNA 完整性,并生成核糖体比率。本应用简报描述的新软件算法开发用于从生物分析仪电泳图提取 RNA 样品完整性的信息。
前言
确定 RNA 起始材料的完整性是基因表达分析中的一个关键步骤。Agilent 2100 生物分析仪系统及相关的 RNA 6000 Nano 试剂盒和 Pico 试剂盒已成为 RNA 质量评估和定量的标准[1,2]。在精密加工的芯片上利用电泳分离,分离 RNA 样品,并通过激光诱导荧光检测法检测。通过生物分析仪软件可显示图像如电泳图和凝胶图以及多种分析结果如样品浓度和核糖体比率。电泳图提供了 RNA 样品质量的详细直观评估结果。然而,依赖肉眼观察解释数据的方法本身存在缺陷。此前,研究者们已将核糖体比率作为特征值应用在生物分析仪软件中,用来表征凝胶分析中 RNA 的完整性。然而,仅通过总 RNA 的核糖体比率去评估 RNA 完整性通常不准确[3]。通过显示 RNA 片段大小分布的详细画面,Agilent 2100 生物分析仪系统提供更好的 RNA 完整性评估结果。

图 1
总 RNA 样品经过不同时间降解,并且在Agilent 2100 生物分析仪系统上使用真核细胞总 RNA Nano 分析法分析所得的样品。随着降解推进,可以观察到向较短片段大小方向偏移
总 RNA 样品经过不同时间降解,并且在Agilent 2100 生物分析仪系统上使用真核细胞总 RNA Nano 分析法分析所得的样品。随着降解推进,可以观察到向较短片段大小方向偏移
RNA 降解是一个逐渐的过程。随着降解推进(图 1),18S/28S 核糖体条带比减小,而两个核糖体峰和下位内标之间的基线信号增大。生物分析仪软件自动生成 18S/28S 核糖体亚基的比率。尽管核糖体比率在确定凝胶电泳中样品降解程度方面发挥重要作用,但 Agilent 2100 生物分析仪系统中更详细的分析表明, 该比率未充分描述样品完整性。
为了将 RNA 完整性解释过程标准化, 安捷伦科技有限公司已经推出一种新的 RNA 质量评估工具。开发 RNA 完整值(RIN)从整体电泳图出发,以消除 RNA 质量控制中的个人解释。它将完整电泳图纳入考量。基于 1 至 10 的编号系统,RIN 软件算法可将真核生物总 RNA 分类,其中 1 代表降解最严重的情况并且 10 代表最完整。通过这种方式,有助于解释电泳图,令样品比较成为可能,并确保实验的重复性。
RIN 工具的开发
RIN 软件算法针对 Agilent 2100 生物分析仪系统中用真核生物总 RNA Nano 分析法采集的样品开发。输入数据包括来自三个哺乳动物物种(人类、小鼠和大鼠)的不同组织中约 1300 份总 RNA 样品,所有样品的完整程度各不相同。RNA 样品的分类由应用专家手动进行,他们将每份总 RNA 样品分类至 1-10 的预定编号系统。图 2 展示了不同 RIN 类别的代表性电泳图(编号分别为10、6、3、2)。

图2
用于调试 RNA 完整值(RIN) 软件的样品电泳图。样品为完整样品(RIN 10) 至降解样品(RIN 2)
为开发 RIN 算法,采用了神经网络等自适应学习工具(工具由Quantiom Bioinformatics 提供)。这些工具允许确定可以从电泳图提取的关键特征。这些特征值采用的是电泳图的组成部分如信号峰面积,强度,比值等。图 3 中列出电泳图的重要要素。他们包括不同的区域(前区、5S区、快速区、中区、前体区、后区)和峰(标准品、18S、28S)。

图 3
详述提示RNA 质量的各区域的电泳图
RIN 可视化
先前版本生物分级软件中存在的数据可以同样存在于下一版 Expert 软件中,例如 RNA 面积、RNA 浓度和 rRNA 比率。RIN 软件包括 RIN 值(图 4),该值可以表述为小数或整数。RIN 值可以在“全局高级”设置下的“设点浏览器”中的“分析性质”选项卡中从小数变为整数。如果软件在某些区域发现意外的峰或信号,可能无法计算 RIN 值。
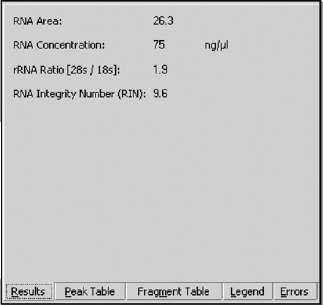
图4
Agilent 2100 生物分析仪系统Expert 软件中的RIN 可视化。“结果”选项卡中显示 RIN 值, 而“错误”选项卡将包含在RIN 未计算情况下有用的信息
这将产生提示已检测到异常的错误 消息(列在软件的错误选项卡中)。异常包括基因组 DNA 污染、鬼峰、尖峰和波浪状基线。异常可以分为两类:关键和非关键。非关键异常因素(如后区的尖峰)仍可以计算 RIN 值,而关键异常(如快速区的尖峰)将导致 RIN 值无法计算。如果认定某个异常非关键(如基因组污染,此事应当进行 DNA 酶消化以获取有意义的数据),对于已经标记的样品,仍可以通过在“设点浏览器”的高级设置中提高异常阈值设定,计算 RIN 值(图 5)。异常阈值检测的最大值为 1。错误消息的描述将与适当阈值相对应。

图5
改变异常阈值和 RIN 单位小数表示。如果分析期间已经检测到关键异常,则在许多情况下仍可以通过提高阈值(最大值为 1)计算 RIN 值。可以在“错误”选项卡中找到关于异常的信息
利用 RIN 得到的结果
开发 RIN 软件以消除依赖用户的 RNA 质量解释过程。总 RNA 样品的表征基本上与仪器、样品浓度和操作者无关,从而允许跨不同实验室比较样品。
RNA 完整性
图 6 展示三份完整程度状态不同的 RNA 样品。RIN 工具赋予三种不同命名,代表相应的完整性。在样品与调试算法时所用样品不同的大型验证研究期间,得到了可靠的样品分类。
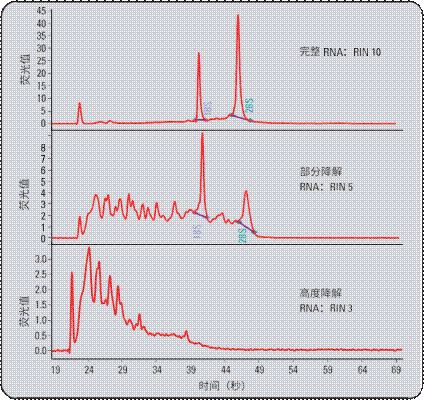
图6
在完整程度不同的样品上检验 RNA 完整值。RIN 软件算法能够将样品精确分类
核糖体比率
图 7 显示了在三台不同仪器上分析的同一份人脑 (Ambion, Inc.) 总 RNA 样品,并且显示了仪器 1 和仪器 3 的代表性电泳图。将采用生物分析仪软件生成的核糖体比率与 RIN 值比较。对于 36 份样品,与 RIN 值相比,采用核糖体比率时变异程度较大。RIN 计算值的变异系数为 1.4%, 而核糖体比率的变异系数为 5.1%。谨记这些 CV 值指向相同样品。研究发现,当比较不同来源的物种或组织的样品时,核糖体比率的CV值显著增大。
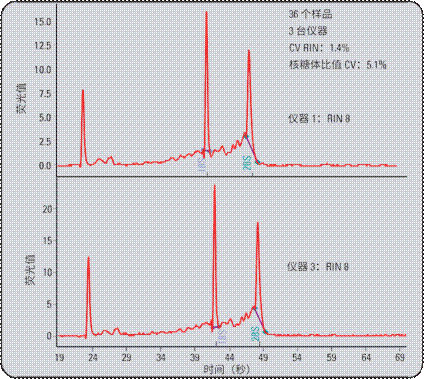
图7
三台不同仪器上分析 36 份总 RNA 样品。将 RIN 与核糖体比率比较。RIN 工具的 CV 显著低于核糖体比率
不同稀释浓度的样品得到的图像类似(图8)。将小鼠脑组织的样品稀释为以下三个浓度:25ng/μl,100ng/μl和500ng/μl。被测108份样品中,RIN值显著大于核糖体比率。RIN 的变异系数为3%,而核糖体比率的变异系数则为 22%。应当指出,低于 25 ng/µL时,不能获得准确的 RIN 值。对于大于 50 ng/µL 的样品浓度,获得最佳结果。
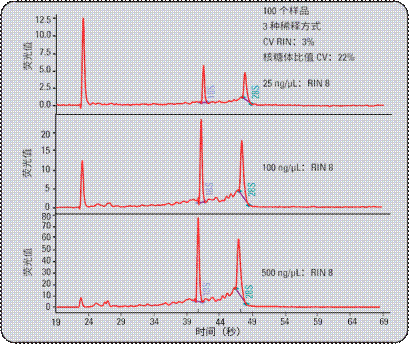
图8
检验不同稀释程度的同一份 RNA 样品时,以狭窄限值范围获得相同的RIN 值,而核糖体比率显示重现性差得多
RIN 的应用
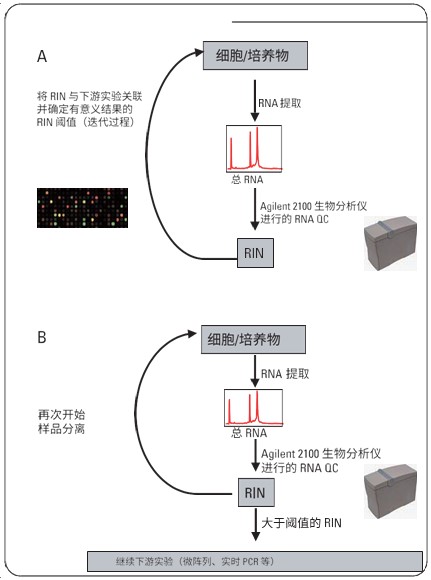
RIN 是测量 RNA 完整性的一款强大的新工具。图 9 中的图示给出了 RIN 的最佳实际使用案例。作为第一步,应当验证 RIN 值(图 9A)。这可以通过将 RIN 值与特定下游实验如微阵列分析或 RT-PCR 关联来进行。可以利用这个关联步骤在成功的下游实验和失败的实验间建立 RIN 阈值。可以在现有生物分析仪数据集合(如可获得)上进行此步骤。在已经建立阈值后,这个值可以用于标准 RNA 质量控制程序(图 9B)。RIN 高于阈值的所有样品通过 QC 检验,而丢弃 RIN 低于阈值的样品。如果重要实验参数变更(例如,研究不同的生物、使用不同类型的微阵列、采用不同的探针集等),则应当重复验证 RIN 的关联步骤。截至目前,已采用真核生物总 RNA Nano 分析法检验 RIN 算法。
RIN 局限性
RIN 旨在提供明确的 RNA 完整性评估结果。给出了样品完整性的衡量标准,它可用于直接比较运输前后的样品,或用于比较不同实验室间的样品。最重要的是,它可以用来确保基因表达实验的重复性,只要涉及样品提取步骤。然而,在无前期验证工作的情况下,RIN 不能预测基因表达数据的效能。例如,一份样品可能过度降解而无法进行全基因组微阵列实验,但可能产生良好的 RT-PCR 数据。为了有效利用RIN,必须进行必要的关联工作。
结论
我们已经设计出一款能够比核糖体比率更好评估 RNA 质量的软件算法。RIN 工具是 RNA 完整性评估标准化的重要环节。研究者不再受困于总 RNA 的主观分类。通过进行关联实验,可创建阈值以确保实验的重复性。已经发现 RIN 工具基本上没有仪器变异性及浓度变异性, 因此有助于仪器间及实验室间样品的比较。
参考文献
1.“Quantitation comparison of total RNA using the Agilent 2100 bioanalyzer, ribo- green analysis, and UV spectrometry” (采用 Agilent 2100 生物分析仪、RiboGreen 分析试剂和紫外光谱对总RNA进行定量比较),安捷伦应用简报,出版号 5988-7650EN, 2002
2.“A microfluidic system for high-speed reproducible DNA sizing and quantita- tion”, Electrophoresis, 21(1), 128-34,
2000
3.“Advancing the quality control methodology to asses isolated total RNA and generated fragmented cRNA”(通过改进质量控制方法评估游离总RNA 以及生成的 cRNA 片段,安捷伦应用简报,出版号5988-9861EN, 2003
致谢
我们要特别感谢合作伙伴 Ambion Inc.、德国基因组研究资源中心 (RZPD) 以及 Quantiom Bioinformatics。我们还要特别感谢对 RIN 算法进行内部测试并提供宝贵意见的所有研究人员。
先前版本生物分级软件中存在的数据可以同样存在于下一版 Expert 软件中,例如 RNA 面积、RNA 浓度和 rRNA 比率。RIN 软件包括 RIN 值(图 4),该值可以表述为小数或整数。RIN 值可以在“全局高级”设置下的“设点浏览器”中的“分析性质”选项卡中从小数变为整数。如果软件在某些区域发现意外的峰或信号,可能无法计算 RIN 值。

图4
Agilent 2100 生物分析仪系统Expert 软件中的RIN 可视化。“结果”选项卡中显示 RIN 值, 而“错误”选项卡将包含在RIN 未计算情况下有用的信息
这将产生提示已检测到异常的错误 消息(列在软件的错误选项卡中)。异常包括基因组 DNA 污染、鬼峰、尖峰和波浪状基线。异常可以分为两类:关键和非关键。非关键异常因素(如后区的尖峰)仍可以计算 RIN 值,而关键异常(如快速区的尖峰)将导致 RIN 值无法计算。如果认定某个异常非关键(如基因组污染,此事应当进行 DNA 酶消化以获取有意义的数据),对于已经标记的样品,仍可以通过在“设点浏览器”的高级设置中提高异常阈值设定,计算 RIN 值(图 5)。异常阈值检测的最大值为 1。错误消息的描述将与适当阈值相对应。

图5
改变异常阈值和 RIN 单位小数表示。如果分析期间已经检测到关键异常,则在许多情况下仍可以通过提高阈值(最大值为 1)计算 RIN 值。可以在“错误”选项卡中找到关于异常的信息
利用 RIN 得到的结果
开发 RIN 软件以消除依赖用户的 RNA 质量解释过程。总 RNA 样品的表征基本上与仪器、样品浓度和操作者无关,从而允许跨不同实验室比较样品。
RNA 完整性
图 6 展示三份完整程度状态不同的 RNA 样品。RIN 工具赋予三种不同命名,代表相应的完整性。在样品与调试算法时所用样品不同的大型验证研究期间,得到了可靠的样品分类。

图6
在完整程度不同的样品上检验 RNA 完整值。RIN 软件算法能够将样品精确分类
核糖体比率
图 7 显示了在三台不同仪器上分析的同一份人脑 (Ambion, Inc.) 总 RNA 样品,并且显示了仪器 1 和仪器 3 的代表性电泳图。将采用生物分析仪软件生成的核糖体比率与 RIN 值比较。对于 36 份样品,与 RIN 值相比,采用核糖体比率时变异程度较大。RIN 计算值的变异系数为 1.4%, 而核糖体比率的变异系数为 5.1%。谨记这些 CV 值指向相同样品。研究发现,当比较不同来源的物种或组织的样品时,核糖体比率的CV值显著增大。

图7
三台不同仪器上分析 36 份总 RNA 样品。将 RIN 与核糖体比率比较。RIN 工具的 CV 显著低于核糖体比率
不同稀释浓度的样品得到的图像类似(图8)。将小鼠脑组织的样品稀释为以下三个浓度:25ng/μl,100ng/μl和500ng/μl。被测108份样品中,RIN值显著大于核糖体比率。RIN 的变异系数为3%,而核糖体比率的变异系数则为 22%。应当指出,低于 25 ng/µL时,不能获得准确的 RIN 值。对于大于 50 ng/µL 的样品浓度,获得最佳结果。

图8
检验不同稀释程度的同一份 RNA 样品时,以狭窄限值范围获得相同的RIN 值,而核糖体比率显示重现性差得多
RIN 的应用
RIN 是测量 RNA 完整性的一款强大的新工具。图 9 中的图示给出了 RIN 的最佳实际使用案例。作为第一步,应当验证 RIN 值(图 9A)。这可以通过将 RIN 值与特定下游实验如微阵列分析或 RT-PCR 关联来进行。可以利用这个关联步骤在成功的下游实验和失败的实验间建立 RIN 阈值。可以在现有生物分析仪数据集合(如可获得)上进行此步骤。在已经建立阈值后,这个值可以用于标准 RNA 质量控制程序(图 9B)。RIN 高于阈值的所有样品通过 QC 检验,而丢弃 RIN 低于阈值的样品。如果重要实验参数变更(例如,研究不同的生物、使用不同类型的微阵列、采用不同的探针集等),则应当重复验证 RIN 的关联步骤。截至目前,已采用真核生物总 RNA Nano 分析法检验 RIN 算法。

图 9
A. 将RIN 值与下游实验(例如微阵列或RT-PCR)关联并确定获得有用基因表达结果的阈值
B. 在已经进行初始关联实验并已经设定数据阈值后,RIN 值可以用于丢弃在Agilent 2100 生物分析仪系统中未通过样品QC 的样品(RIN 值低于阈值)
A. 将RIN 值与下游实验(例如微阵列或RT-PCR)关联并确定获得有用基因表达结果的阈值
B. 在已经进行初始关联实验并已经设定数据阈值后,RIN 值可以用于丢弃在Agilent 2100 生物分析仪系统中未通过样品QC 的样品(RIN 值低于阈值)
RIN 局限性
RIN 旨在提供明确的 RNA 完整性评估结果。给出了样品完整性的衡量标准,它可用于直接比较运输前后的样品,或用于比较不同实验室间的样品。最重要的是,它可以用来确保基因表达实验的重复性,只要涉及样品提取步骤。然而,在无前期验证工作的情况下,RIN 不能预测基因表达数据的效能。例如,一份样品可能过度降解而无法进行全基因组微阵列实验,但可能产生良好的 RT-PCR 数据。为了有效利用RIN,必须进行必要的关联工作。
结论
我们已经设计出一款能够比核糖体比率更好评估 RNA 质量的软件算法。RIN 工具是 RNA 完整性评估标准化的重要环节。研究者不再受困于总 RNA 的主观分类。通过进行关联实验,可创建阈值以确保实验的重复性。已经发现 RIN 工具基本上没有仪器变异性及浓度变异性, 因此有助于仪器间及实验室间样品的比较。
参考文献
1.“Quantitation comparison of total RNA using the Agilent 2100 bioanalyzer, ribo- green analysis, and UV spectrometry” (采用 Agilent 2100 生物分析仪、RiboGreen 分析试剂和紫外光谱对总RNA进行定量比较),安捷伦应用简报,出版号 5988-7650EN, 2002
2.“A microfluidic system for high-speed reproducible DNA sizing and quantita- tion”, Electrophoresis, 21(1), 128-34,
2000
3.“Advancing the quality control methodology to asses isolated total RNA and generated fragmented cRNA”(通过改进质量控制方法评估游离总RNA 以及生成的 cRNA 片段,安捷伦应用简报,出版号5988-9861EN, 2003
致谢
我们要特别感谢合作伙伴 Ambion Inc.、德国基因组研究资源中心 (RZPD) 以及 Quantiom Bioinformatics。我们还要特别感谢对 RIN 算法进行内部测试并提供宝贵意见的所有研究人员。
来源:安捷伦科技(中国)有限公司(Genomics)
联系电话:800 820 3278,400 820 3278,010-64397888
E-mail:inquire-china_lsca@agilent.com
联系电话:800 820 3278,400 820 3278,010-64397888
E-mail:inquire-china_lsca@agilent.com
标签:
RNA 质量控制





