使用GC/ICP-MS对生物组织中有机锡化合物进行形态分析

使用GC/ICP-MS对生物组织中有机锡化合物进行形态分析
引言
由于有机锡在农业, 工业和家庭中被广泛使用, 因此其对环境的影响受到了极大的重视[1]。 丁基锡和苯基锡已被广泛用作活性杀生物剂, 在防污涂料、 聚氯乙烯(PVC) 稳定剂、木材处理, 以及其他方面都有应用[2]。 例如, 当被用于防污涂料时, 痕量水平(ppt) 的丁基锡和苯基锡将会对非靶标生物造成严重损害, 并在沉积物和生物群中累积[3-4]。 因此, 欧盟(EU) 将三丁基锡(TBT) 及其降解产物列入到优先控制污染物名单中(修订水框架指令2000/60/EC的决定2455/2001/EC) [4]。美国环境保护署(EPA) 对TBT建立了环境水生生物水质标准, 其中防止海洋水生生物免受慢性毒作用的标准值是3 ng Sn/L, 而免受急性毒作用的标准值则为172 ng Sn/L[4]。 由于TBT、 三苯基锡(TPhT) 以及它们的降解产物(二取代锡,单取代锡和无机锡) 各自的毒性存在差异, 而且对环境影响的监测也不相同,因而非常有必要对有机锡的形态进行分析[5]。
如今, 由于气相色谱-电感耦合等离子体质谱(GC/ ICP-MS) 联用法具有灵敏度高, 选择性好, 可以同时分析多种元素和多种同位素等优势, 因此成为了金属有机物痕量分析的首选方法[3]。 通过GC/ ICP-MS开展有机锡形态分析, 为了增加各形态的挥发性, 需要加入四丙基硼酸钠或四乙基硼酸钠进行衍生化反应。 此外, 对于复杂基质, 如生物组织和沉积物的分析, 在有机锡化合物衍生前需要进行软提取, 以保持分析物的形态不发生改变。 开放微波提取由于具有快速和高效的优点, 是最流行的提取方法[3]。 本实验使用GC/ ICP-MS(CLARUS®GC和NexION®ICP-MS) 对有机锡形态进行分析, 更具体地说, 是通过外标法对生物样品中的单丁基锡、 二丁基锡和三丁基锡进行分析。 而且在实验中特别注意了对连接GC和ICP-MS的GC传输线参数的优化。

实验条件
试剂和化学品
甲基三氯化单锡(MMT, 97%) , 二甲基二氯化锡(DMT, 97%) , 三甲基氯化锡(TMT, 97%) , 三 氯 化 一 丁 基 锡 (MBT , 95 % ) , 二 氯 化 二丁基锡(DBT, 97%) , 和三丁基氯化锡储备溶液(TBT, 96%) 均购自Sigma-Aldrich公司™, 并使用冰乙酸(HAc) (GFS化工) 配制。 使用四丙基硼酸钠(NaBPr4) (Merseburger Spezialchemikalien, 德国) 进行衍生化。 衍生化过程中使用的缓冲溶液(0.1M, pH 4.9) 由MQ水溶解醋酸钠和冰乙酸(HAc) 制得。 HPLC级异辛烷和Optima级甲醇(MeOH) 购自Thermo Fisher Scientific™。
高纯度的氢氧化铵(NH 4 OH) 、 硝酸(HNO3 ) 、 盐酸(HCl) 的氢氧化四甲基铵(TMAH, 25%)
均购自GFS化工(GFS Chemicals) 。 在本实验中使用的标准参考物质贻贝组织(CRM477) 购自标准参考物质和测量研究所(IRMM; 比利时基尔) , 而牡蛎组织样品则来自法国阿卡雄湾(Arcachon Bay) 。
仪器
使用PerkinElmer® Clarus 580气相色谱与NexION 300D电感耦合等离子体质谱仪(ICP-MS) 联用进行实验的分析工作, GC与ICP-MS的连接通过PerkinElmer GC/ICP-MS传输线实现(见图1) 。 将配有一个内失活毛细管柱的Silcosteel®管传输线插入到石英炬管和中心管中。 对干式等离子体条件下仪器工作条件(如: 内失活的毛细管柱的距离、 Ar气组成和氧气(O2) 流速) 的优化进行了评价。 使用一台SP-D Discover聚焦微波系统(CEM公司, 美国北卡罗莱纳州马修斯)从基质中提取有机锡。 仪器操作条件详见表1。 使用NexION ICP-MS和 Chromera® CDS软件完成数据的收集和分析。
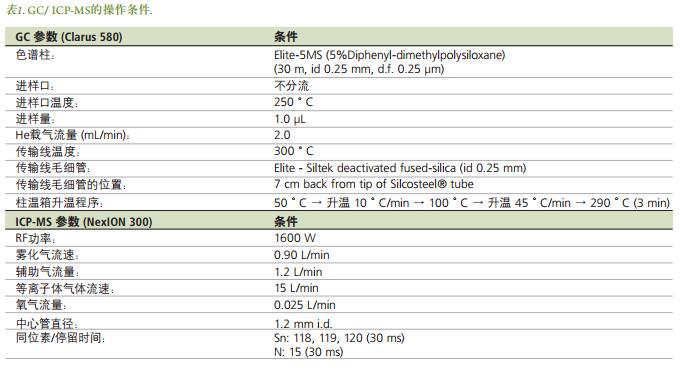
样品制备
样品制备, 微波萃取和衍生化均已有文献资料记载[3-4]。甲基锡和丁基锡的储备溶液(1000微克/毫升) 使用浓
的冰醋酸制备。 工作溶液使用1% HCl将贮备溶液按比例进行稀释得到, 每日现配, 并低温保存。 标准系列各标准溶液重复测定3次后得到校准曲线。 对于衍生化,称取大约4.4克乙酸钠, 加入1.0毫升醋酸, 然后使用MQ水溶解并定容至500mL, 配制成醋酸盐缓冲溶液(0.1M, pH 4.9)。 此外, 使用MQ水配制2.5% 的NaBPr4溶液作为衍生化试剂, 并于暗处保存。
微波萃取
在对贻贝和牡蛎组织中有机锡化合物进行微波萃取时, 分别在10mL提取小瓶中加入0.15 g干样, 然后再向干样中加入4 mL 25% TMAH。 在每个提取小瓶中加入1个小的磁力搅拌棒, 以保证萃取过程中浆液的充分均匀化。 微波消解后, 根据需要, 可以对样品进行离心, 然后将上清液转移到干净的小瓶中, 并在冰箱中储存, 待测。 本实验使用的微波程序详见表2.

衍生程序
在20 mL玻璃小瓶中进行衍生化。 首先, 将5mL的醋酸盐缓冲液分别加入到已加入20, 50, 100和200μL含有5 ng / mL有机锡的标准工作溶液中。 根据需要, 使用HCl或NH4OH将各溶液的pH值调至5.0。 然后向小瓶中加入1mL异辛烷和250μL 2.5%的NaBPr4, 盖好瓶盖,并手动振摇5分钟。 然后将有机相转移到GC小瓶中进行分析。 以相同的方式制备3个空白溶液, 一方面可以进行检出限测定, 另一方面也可以发现样品制备过程中可能发生的任何污染的特征。 对于生物组织的分析, 分别将30μL的贻贝组织和300μL的牡蛎组织提取液加入5毫升缓冲液, 并使用HCl或NH4OH将溶液的pH值调至5.0。 然后, 分别向小瓶中加入1mL的异辛烷和500μL的2.5%NaBPr, 盖好瓶盖, 并手动振摇5分钟。 将有机相转移到GC小瓶中进行分析。 图2概述了本实验样品制备过程的流程。
在清洁的条件下工作对于低浓度分析的成功是非常重要的。 容器均使用洗涤剂进行清洗, 然后分别用硝酸和盐
酸浸泡(10%V: V, MQ水) , 不同酸浸泡后使用MQ水冲洗。 清洗完成后, 将容器置于层流罩下干燥保存, 待用。
结果与讨论
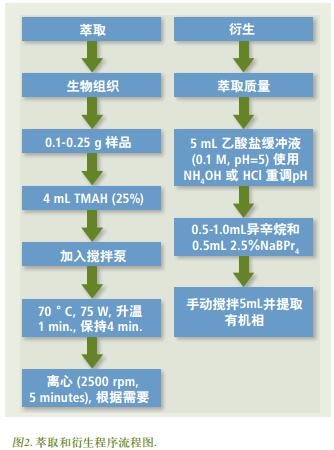
操作参数的优化主要涉及GC输送线和ICP-MS炬管, 如内毛细管柱距离, Ar组成气流速(即雾化气) 和氧气(O2) 的加入, 分别使用载气氦(He) 的氮气(N2)杂质(同位素15) 连续信号进行评估。 O2的添加是必要的, 以防止异辛烷在ICP-MS采样锥产生积碳[5]。 虽然本实验使用15N+的响应值进行优化, 在之前的研究中还有使用氙气/氩气混合气(50ppm) 的报道[6]。
PerkinElmer提供的GC传输线, 可用于CLARUS或 AutoSystem ™ GC , 也可用于CLARUS 或AutoSystem™GC与NexION或ELAN®的ICP-MS平台的联用。 CLARUS GC系统对GC传输线的温度进行控制, 以维持传输线中的分析物处于气相, 并防止出现冷点[7]。 Ar气流速由ICP-MS雾化器控制, 并在进入传输线前进行加热。 足够的流量对于待测物质有效的传送到等离子体中是很重要的。 通过三通(“T” 加入)氧气, 而且氧气同样要通过传输线。 仪器设定完成后点炬, 测定15N+响应值, 并根据15N+响应值进行优化。根据前期的工作, O2气加入量和内失活毛细管柱位置的优化值(距离传输线中Silcosteel®管末端的相对位置) 分别为0.025 L/min 和 7 cm[7]。 通过在0.8-1.0 L/min 范围内改变Ar组成气(O2流量为0.025 L/min)气流量, 当观察到5N+响应值最大时, 确定最优Ar组成气气流量。 在确定好最优条件后, 注入有机溶剂(例如, 异辛烷, 己烷, 丙酮等) , 以确保待测物质能够进入等离子体。 图3为注入异辛烷时5N+同位素信号典型的相应图。 5N+基线信号在2.5分钟时的抑制正好与有机溶剂在等离子体中的燃烧相对应, 从而证明了GC气体流渗透进入到等离子体中。 GC/ICP-MS系统的最优条件列于表1。
分析性能
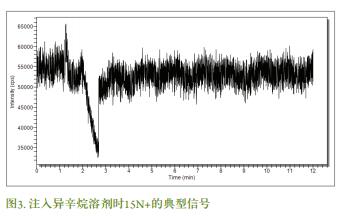
使用丁基锡标准溶液确定分析响应特性。 Sn同位素(118, 119和120) 校正曲线的生成由重复三次注射1µL的标准溶液得到, 标准溶液的浓度范围从0(即空白) 到2 ng/mL, 使用异辛烷溶液配制。由 120Sn响应函数(图4) 可见校准曲线具有良好的线性度和令人满意的相关系数(R 2值) 。 检出限(LOD=3σblank/m) 则由每个校准响应函数得到,并且120Sn的MBT、 DBT 和 TBT的绝对检出限分别为18, 200和7 fg。 DBT的绝对检出限较高可能是因为空白纸较高, 而空白值高则与化学品制备过程中使用的容器和试剂所造成的污染有关。 这种现象很常见, 因为DBT被用于工业合成塑料。
色谱分离和方法验证
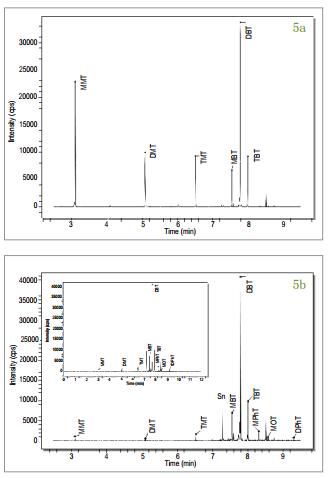
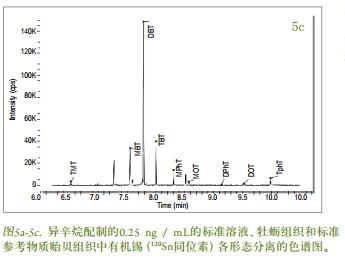
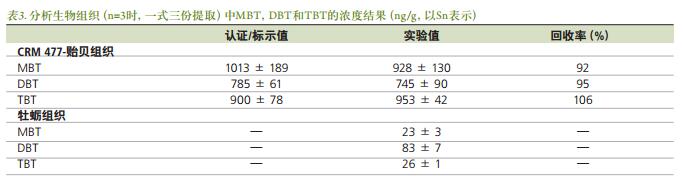
图5a-c分别显示了用异辛烷配制的0.25 ng / mL的标准溶液、 牡蛎组织和标准参考物质贻贝组织中有机锡(120Sn同位素) 各形态分离的色谱图。 再方法的开发过程中对多个Sn同位素(118, 119, 120) 进行了监测, 但为简单起见, 仅列出了120Sn的结果。 色谱条件(表1) 的选择主要是按照使各形态物质从溶剂洗脱物干扰区域分离的方式的进行[1]。 存在于生物组织样品中的丁基锡化合物的定量结果通过外标法得到。 一式三份提取的贻贝组织标准参考物质用于本实验方法的验证。 将实验测得的MBT, DBT和TBT值与认证值进行比较, 结果列于表3。 虽然牡蛎组织样本中丁基锡形态物质的浓度值没有被标定, 但由图3还是可以看见其实验浓度值。 表1中列出的温度程序为机锡化合物的有效分离提供了保证, 可以在不到11分钟的时间里完成分离, 而且峰宽为2-3s。 图5a为优化条件下用异辛烷配制的含有甲基锡、 丁基锡形态物质(质量数为120) , 浓度为0.25 ng / mL的标准溶液的色谱图。 通过图5b和图5c, 可以看见牡蛎和贻贝组织的色谱分离图中还有其它在环境样品中常见的有机锡形态物质的存在, 如:一辛基锡、 二辛基锡、 一苯基锡、 二苯基锡、 三苯基锡等。 色谱图中所有的峰型都能清楚的被识别。 8.5分钟时出现的峰型可能是由于NaBEt的杂质造成, NaBEt4是在衍生化阶段加入的试剂, 这些杂质可能会使得有机锡的形态物质生成乙基化产物。 还需要开展进一步工作以证实这些物质。
结论
本文提出了使用GC传输线联接CLARUS GC和NexIONICP-MS检测系统成果对生物组织进行分析的方法。 丁基锡的形态具有良好的线性响应函数, 在完成参数优化后, 确定了仪器LODs。 将有机锡化合物的GC色谱分离应用于贻贝组织标准参考物质和牡蛎组织的分析。用外标法对生物组织中丁基锡形态的定量和验证, 本实验得到的回收率≥92%, 相对标准偏差≤14%。
参考文献
1. Aguerre, S., Pécheyran, C., Lespes, G., Krupp, E.,Donard, O.F.X., Potin-Gautier, M. J. Anal. At. Spectrom.16, (2001), 1429.
2. De Carvalho Oliviera, R., Erthal Santelli, R., Talanta82 (2010), 9.
3. Monperrus, M., Rodríguez Martin-Doimeadios, R.C.,Scancar, J., Amouroux, D., Donard, O.F.X. Anal.Chem. 75, (2003), 4095.
4. Jiménez Moreno, M., Pacheco-Arjona, J., RodríguezGonzález, P., Preud’Homme, H., Amouroux, D.,Donard, O.F.X. J. Mass Spectrom. 41, (2006), 1491.
5. Rodriguez Pereiro, I., Schmitt, V.O., Szpunar, J.,Donard, O.F.X., Lobinski, R. Anal. Chem. 68,(1996), 4135.
6. Castro, J., Tessier, E., Neubauer K., and Donard,O.F.X., “Mercury speciation in biological tissues andsediments by GC-ICPMS”, PerkinElmer Application Notes(www.perkinelmer.com), 2012.
7. Bouyssiere, B., Szpunar, J., Lobinski, R.,Spectrochimica Acta Part B. 57, (2002), 805.





