Exactive Plus EMR 高分辨质谱仪实现非变性状态ADCs 药物的分析
李静
赛默飞世尔科技(中国)有限公司色谱质谱部
杨淑君 韩念和 荐立
上海新理念生物医药科技有限公司
关键词
Exactive Plus EMR;ADCs;cysteine -linked ADCs;Native MS
1 前言
单克隆抗体被认为是具有高度特异性的靶向药物,其对肿瘤细胞的靶向性非常高。而抗体- 药物偶联物(Antibody-drug conjugates,以下简称ADCs)技术,就是在抗体蛋白的特定氨基酸上偶联具有抗肿瘤作用的高效应化疗药物(或称小分子药物),以增加单克隆抗体的疗效、并降低小分子药物的毒性。相比单克隆抗体,ADCs 药物的生产工艺更为复杂,因此为了保证ADCs 药物的安全性和有效性,需对ADCs 药物的质量进行监控。药物抗体比(drug to antibody ratio,以下简称DAR)是评价ADCs 药物的生产工艺和产品质量的一个重要参数。目前大部分上市和在研ADCs 药物主要包括基于抗体自身的赖氨酸进行偶联的ADCs 药物(lysine-linked ADCs)和基于抗体自身链间二硫键经还原后的半胱氨酸进行偶联的ADCs 药物(cysteine -linked ADCs)(图1)。两类ADCs 的DAR 测定通常有UV、HIC和MS三种方法,其中MS检测方法因其快速、灵敏度高和强大的定性功能等优点,愈来愈广泛地被用于测定ADCs 的DAR。目前MS 用于测定ADCs 的DAR 通常是基于传统的RPLC/MS 平台,该平台下RPLC 采用的流动相呈酸性,且含有较高浓度的乙腈,蛋白在此条件下大多发生变性, 因此测定结果严格意义上讲反映的是ADCs 变性后的DAR。对于lysine-linked ADCs 而言,上述变性条件不影响其抗体结构的完整性,故RPLC/MS 平台不影响其DAR 测定。然而, 对于cysteine-linked ADCs 而言,上述变性条件破坏了维持抗体空间结构的非共价作用,ADCs 部分解离其轻链或重链,故RPLC/MS 平台无法用于其DAR 测定。随着非变性质谱(Native MS)技术的不断发展和推广,采用非变性质谱进行cysteine-linked ADCs 分析显示了强大的应用潜力。
Thermo ScientificTM ExactiveTM Plus EMR 质谱仪保持了Orbitrap 高分辨率、高质量精度的优势,同时扩展质量数范围至m/z 20000,并且在硬件设计上提升高质量端离子的传输效率,改进了HCD 压力,使其更加适用于完整蛋白质的分析。
适用于保留有三级和四级结构的非变性蛋白质和蛋白复合物的结构学、拓扑学研究以及生物制药中非变性状态下cysteine-linked ADCs 的分析。
本实验建立了基于ExactiveTM Plus EMR 和Protein Deconvolution 3.0 软件的非变性状态下蛋白质的分析流程(图2),并成功用于cysteine-linked ADCs 的分析,测定载有不同药物分子数的ADCs混合物的精确分子量,并测定其DAR值。

图1 Cysteine-linked ADCs 示意图
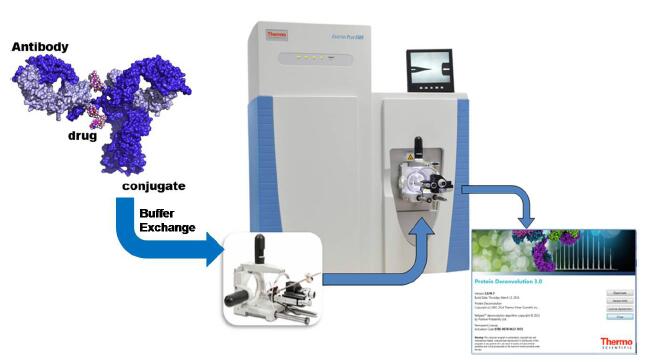
图2 非变性状态Cysteine-linked ADCs 的分析流程
2实验条件
2.1材料与方法
样品PCT为Cysteine-linked ADCs,PNGase F去糖基化后,采用Micro Bio-Spin® Chromatography Columns进行缓冲溶液交换,保存于100 mM 乙酸铵(pH 7.0)中,配制成浓度为5.5 μM的溶液备用。
2.2质谱分析
|
质谱仪 |
Thermo Scientific Exactive Plus EMR |
|
离子源 |
NanoFlex Source with emitter |
|
质谱数据采集模式 |
Direct Infusion |
|
离子模式 |
正离子 |
|
喷雾电压 |
1.8 KV |
|
毛细管温度 |
275 ℃ |
|
毛细管温度 |
ON |
|
质量范围 |
m/z 3000–10000 |
|
分辨率 |
17500、35000、70000 |
|
S-lens (%) |
200 |
|
In-souce CID |
175 |
|
HCD |
25 |
|
MicroScan |
10 |
|
Spectra average |
50 |
2.3数据处理
采用Thermo ScientificTM Protein Deconvolution 3.0对原始质谱图进行去卷积。
参数如下:
|
Noise compensation |
ON |
|
Minimum adjacent charges |
1 to 3 |
|
Noise Rejection |
95% confidence |
3实验结果
本实验通过直接进样方式,分别设置Orbitrap分辨率为17500,35000,70000, ADCs药物的原始质谱图如图3,ADCs药物的质谱峰主要分布在m/z 5000-7000范围内,具有理想的信噪比。选取两组质谱峰进行放大(图4所示)可以发现,当逐渐提高质谱分辨率时,主峰逐渐与加合离子峰分离。分辨率越高,分离效果越明显。
经Protein Deconvolution 3.0软件去卷积处理之后的不同分辨率下的ADCs药物分子质量分布如图5所示,根据ADCs药物单抗的氨基酸序列和小分子药物的理论分子量进行计算,将观察到的质谱峰进行归属,从图中我们观察到,五个主峰呈现等质量间隔(约2635Da),由此可推断该单抗分子结合了不同数目的药物小分子。结合cysteine-linked ADCs的特点,判断主峰依次为结合了0、2、4、6、8个小分子药物的ADCs混合物,该结果与理论预期一致。
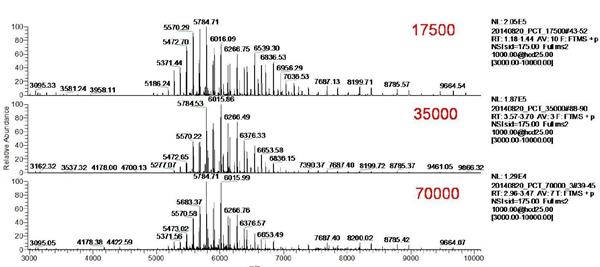
图3 不同分辨率设置下(17500,35000,70000)ADCs药物的原始质谱图
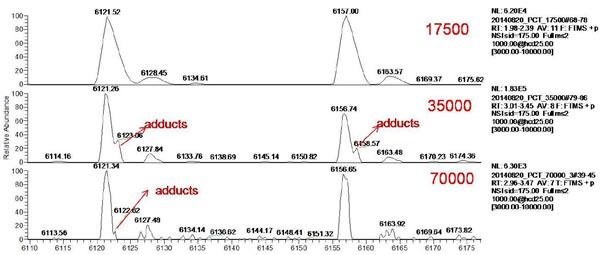
图4 不同分辨率设置下(17500,35000,70000)ADCs药物局部放大质谱图
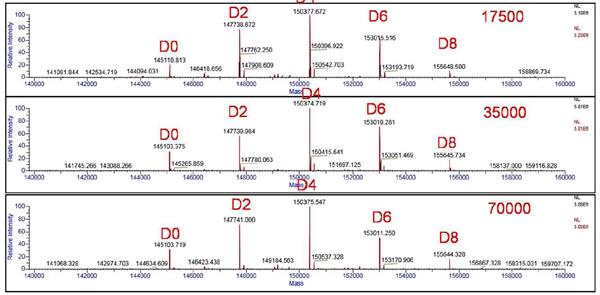
图5 不同分辨率设置下(17500,35000,70000)ADCs药物去卷积后结果
|
Resolution |
Drug
Load |
Measured MW
(Da) |
Theoretical MW
(Da) |
Delta M
(Da) |
|
17500 |
D0 |
145111 |
145103 |
7.7 |
|
D2 |
147739 |
147738 |
0.3 | |
|
D4 |
150378 |
150374 |
4.1 | |
|
D6 |
153016 |
153009 |
6.6 | |
|
D8 |
155649 |
155644 |
4.4 | |
|
35000 |
D0 |
145103 |
145103 |
0.3 |
|
D2 |
147740 |
147738 |
1.6 | |
|
D4 |
150375 |
150374 |
1.1 | |
|
D6 |
153010 |
153009 |
1.4 | |
|
D8 |
155646 |
155644 |
1.6 | |
|
70000 |
D0 |
145104 |
145103 |
0.6 |
|
D2 |
147741 |
147738 |
2.7 | |
|
D4 |
150376 |
150374 |
1.9 | |
|
D6 |
153011 |
153009 |
2.4 | |
|
D8 |
155644 |
155644 |
0.2 |
表1不同分辨率(17500,35000,70000)下去卷积后的精确分子量和质量偏差
不同分辨率(17500,35000,70000)下去卷积后的精确分子量如表1所示,比较发现,当分辨率设置为17500时,由于无法实现主峰和加合离子峰的有效分离,质量与理论值偏差较大,最大偏差达到7.7Da。当分辨率逐渐提升到35000,主峰逐渐与加合离子峰分离,质量偏差控制在0.3-1.6Da,具有极佳的质量准确度。当分辨率逐渐进一步提升到70000时,主峰与加合离子峰分离度进一步提高,同样可获得理想的质量准确度(0.2-2.7Da),满足测定需求。
根据质谱峰的峰强度信息,可计算该药物的DAR值,该数值对于ADCs药物的有效性评估至关重要。以分辨率设置35000下质谱图去卷积结果为例(如图6所示),按照DAR = Σ(relative peak area×number of loaded drugs)/100计算DAR值,获知该ADCs药物DAR=3.9。
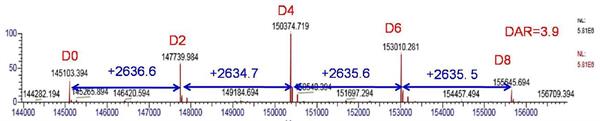
图6 分辨率设置35000下质谱图去卷积后ADCs药物质量分布图(D0-D8表示载有不同药物分子数的ADCs混合物)
4结论
本文采用Exactive Plus EMR质谱仪,直接进样方式,突破了传统的RPLC/MS平台无法进行cysteine-linked ADCs分析的瓶颈,建立了cysteine-linked ADCs的精确分子量测定方法,为cysteine-linked ADCs 单抗药物研发和生产检测提供了高效、快速的分析平台。实验结果表明Exactive Plus EMR质谱仪凭借其超高的分辨率、超快的扫描速度、超高的质量精度、超高的灵敏度以及拓展的质量范围,极大地完善和推动了ADCs药物的鉴定分析。
参考文献
1. Albert J R Heck et al. Nat. Methods 2008, 5(4), 927-933.
2. Sara Rosati et al. Nature Protocols 2014,9(4) , 967-976





