利用气相色谱- 质谱/质谱联用仪进行高灵敏度的亚硝胺分析
利用气相色谱- 质谱/ 质谱联用仪进行高灵敏度的亚硝胺分析
Alex Chen1, Hans-Joachim Huebschmann2, Li Fangyan3, Chew Yai Foong3 and Chan Sheot Harn3
1Alpha Analytical Pte. Ltd., Singapore; 2Thermo Fisher Scientific, Singapore, 3Health Sciences
Authority, HSA Singapore
关键词
亚硝胺,食品安全,啤酒,TSQ 8000,气相色谱- 质谱/ 质谱,定量分析,确认,
自动SRM,TraceFinder
简介
亚硝胺是N- 亚硝基烷基胺一类化合物的通用名。已知的含有不同烷基基团的这类化合物有很多。最简单的N- 亚硝基烷基胺含有两个甲基,即N- 亚硝基二甲基胺(NDMA)。亚硝胺是常见的剧毒化合物,对人和动物都有强致癌性,高剂量的摄入会导致严重的肝损伤和内出血。
食物中的亚硝胺主要是由亚硝酸生成的。亚硝酸通常作为防腐剂被添加到肉及肉制品中,以避免肉毒杆菌造成的中毒。维生素等有抗氧化作用的添加剂能抑制亚硝酸向亚硝胺的转化。亚硝胺的另一个来源是由氮的氧化物与生物碱(alkaloids)反应产生,这一反应在啤酒生产时干燥已萌发的麦芽的过程中已有报道。由于麦芽和啤酒中的亚硝胺水平在发酵过程中已大幅降低,需要更好的分析表现才能胜任此检测任务。而除了其它各项日常食品的常规控制项目之外,啤酒中麦芽的低剂量亚硝胺检测也是必须的。
已采用多年的“经典”亚硝胺检测方法是利用串接热能分析仪(TEA)检测器的气相色谱进行分析的。选择特殊的TEA 检测器是由于该检测器能够从亚硝胺生成NO,NO又能与臭氧进行特异性的化学发光反应,从而实现特异性的亚硝胺检测。而如今,随着对检测方法的灵敏度的要求不断增加,TEA 的检出限及其复杂的操作程序,已无法满足目前的低检出限和高样品通量要求。质谱仪已在不断取代TEA。
由Munch 和 Bassett 于2004 年建立的EPA 方法521 提供了一个适应当时要求的、基于化学电离(CI)和带有内部离子化功能的离子阱质谱仪的气质联用检测方法,而不是标准的带有外部离子源的四极杆或离子阱质谱仪。如今随着技术的发展,GC-MS 三重四极杆也可以在低分子量区域提供高灵敏度和高选择性的分析,使得非常低浓度的亚硝胺检测,甚至是在复杂样品中的低浓度检测,成为可能。这一可能性源于使用更为简便的、利用常规的电子轰击源(EI)的标准技术,来建立低浓度亚硝胺检测的便捷方法。
本应用说明文章描述了一套完整的、使用 GC-MS/MS 进行食品中亚硝胺类化合物常规检测和定量的方法。本工作中的食品基质包括多种不同的麦芽啤酒产品以及作为最终食品产物销售的啤酒本身。在方法开发过程中,我们特别注意优化,以在达到对亚硝胺化合物检测所需的高灵敏度的同时,提供一种迅速、易于实现的常规检测方法。
样品处理方法基于AOAC 官方方法 (2000), 982.11 并略有改动。我们建立了一种使用Celite 硅藻土柱并用DCM 洗脱的固相萃取方法来从啤酒样品中分离亚硝胺。
实验条件
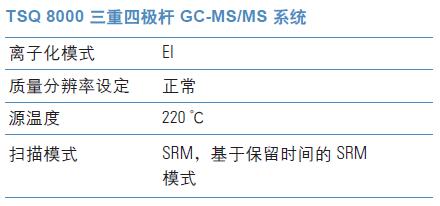
GC-MS/MS 仪器
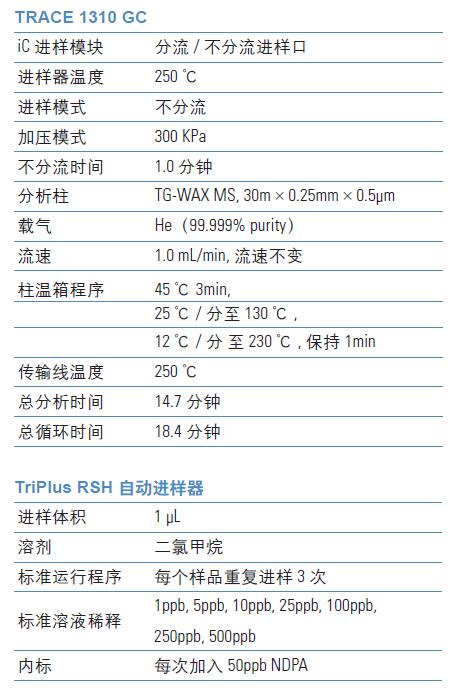
SRM 方法建立
我们使用了Thermo Scientific TSQTM 8000 GC-MS/MS 软件套件中的AutoSRM 软件进行了三重四极杆质谱方法的建立,且并未对AutoSRM 生成的方法进行任何手动修改。一个装有待分析亚硝胺化合物标准品溶液的自动进样器样品瓶专供AutoSRM 程序使用。
AutoSRM 程序自动进行以下三个步骤:
1. 首先对标准品溶液进行全扫描分析(图1.)。从全扫中得到的信号最强的离子将被作为一级离子。
2. 对上一步确定的一级离子(母离子)进行二级离子(子离子)谱图获取(可以根据分析需求设定一级离子的个数)。找出每个一级离子产生的信号最强的二级离子(可以手动选择最感兴趣的一级离子进行进
一步优化)。
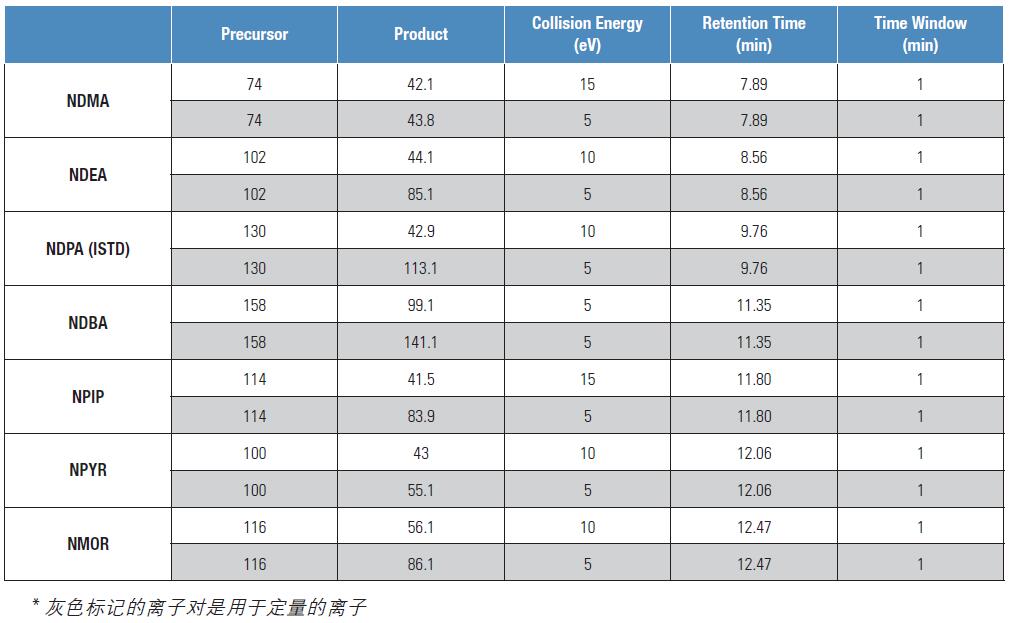
表1. AutoSRM 生成的SRM 方法设置
3. 对所有化合物的选定的母离子/ 子离子对进行碰撞能的优化,以获得最大化合物响应及最佳方法灵敏度(图2)。
AutoSRM 程序能够根据需要从一个标准品样品瓶启动,完成所需的进样次数。
表1 就是由AutoSRM 自动生成的SRM 离子对表格。该表同时还显示了TSQ8000 GC-MS/MS 在Timed-SRM 模式下、在化合物洗脱时间左右用一个60 秒的短采集窗口进行采集的SRM 采集方法。无需对扫描时段进行任何其他的设置,或者说如果需要在某化合物的洗脱时间之外对其进行监测,则需要手动添加该化合物。
样品测定
在大量各种可能的亚硝胺化合物之中,本方法涵盖了那些被报道与发芽麦芽干燥的过程相关的亚硝胺化合物。被分析的样品包括未添加标样的麦芽啤酒样品,以及作为空白样的4%乙醇。如需对其他食物基质进行分析,其它化合物可以随时参照前述AutoSRM 方法建立的步骤添加至本方法中。
实验结果
本方法中包含的亚硝胺类化合物的色谱呈现了较快的流出,从7.87 的NDMA 到12.47 分,能够实现较短的循环时间并提高样品通量。图3 显示了用校准曲线中的最低浓度--1 ppb 的样品得到的峰强度。从图中可见NDMA 检测的信噪比依然很好。
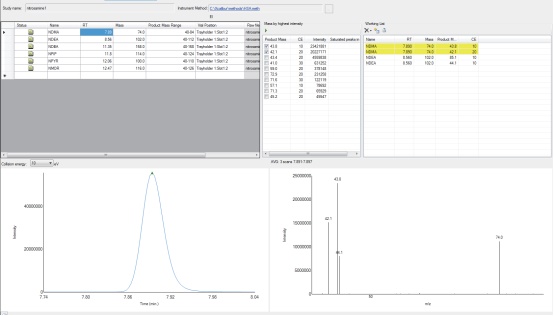
图1. AutoSRM 对NDMA 从EI 全扫谱图中进行一级离子选择
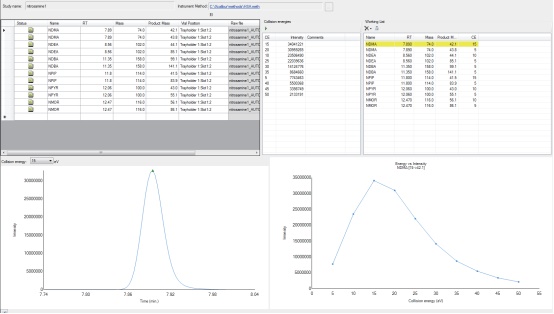
图2. AutoSRM 对所有亚硝胺一级离子进行碰撞能优化
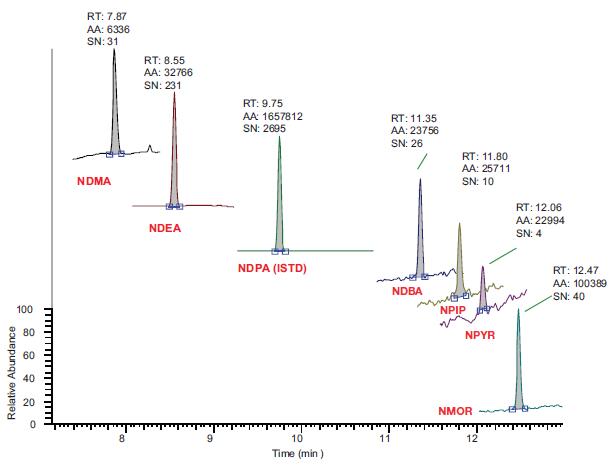
图 3. 浓度为1ppb 的标准品混合物的色谱图
我们在1 ppb 到500 ppb 这一较宽的浓度范围内进行了定量校准。图4 展示了从所有的校准检测中得到的亚硝胺色谱峰。在所有情况下,NDMA 的峰形都是完全对称的,没有拖尾,而且无需任何手动修正就得到了非常可靠的峰面积积分值。图5 所示为用于样品定量的NDMA 校准曲线,曲线R2 大于0.99,可见线性极佳。本TSQ 8000 GCMS/MS 方法对所有亚硝胺都达到了相同水平的校准精度。

图 4. NDMA 从1 ppb ( 底部) 至 500 ppb ( 顶部) 的校准曲线测定结果

图 5. NMDA 从1 ppb 到500 ppb 的校准曲线
LOQ 测定
最低定量限(LOQ)和最低检出限(LOD)的计算都基于色谱峰的信噪比。LOQ 的计算基于的信噪比为10,LOD 基于的信噪比为3。

表2. 本方法LOQ 和LOD 的计算
结果确认
化合物确认是通过Thermo Scientific TraceFinderTM 定量分析软件提供的离子比检查功能实现的,该功能比较了用于定量的SRM 与定性SRM 的离子强度。覆盖1 ppb 到500ppb 浓度区间的标准品被进行了三次重复进样检测并用于计算离子比的精确度,结果显示在表3 中。虽然所有被检测的离子都处于低质量数范围并可能受到多种干扰,二级离子的离子比的精确度一直很好的保持在1-4%。
为了在样本分析中进行质量控制,在用TraceFinder 软件进行定量数据处理时,阳性结果都会通过离子比检查进行确认。对所有化合物来说,采集的两个二级离子的离子比例需保持在± 5%(10%) 范围内,符合从标准品得到的校准值。这为常规的样品检测提供了坚实的安全保障。表3 列出了所有本研究中涉及到的亚硝胺的平均离子比值。
样品检测
我们对多种样品进行了检测,包括空白样和添加了标准品的啤酒样品等。空白样的检测结果如表4 所示。该样品中检出的低浓度NDMA经计算发现低于校正曲线浓度,也低于LOQ。故在此LOQ 下,空白样品可以被确认为不含亚硝胺化合物。
另一个样品通过在啤酒中添加不同浓度的亚硝胺制备而成。所有的亚硝胺化合物都被检出,并在低浓度区间进行了定量,如表5 所示。每个用于定量的峰都通过了离子比质量控制,并且能够在这样的低浓度通过计算离子比对每个检测为阳性的化合物进行确认。
结论
通过本文描述的基于TSQ 8000 系统的GC-MS/MS 方法,所有研究涉及的亚硝胺化合物都能在食品安全控制所要求的低浓度被安全地检出并实现精确的定量。在定量校正曲线所用的最低浓度为1 ppb 的情况下,所有化合物的LOD 都低于1 ppb。TSQ 8000 GC-MS/MS 在1-500 ppb 的范围内显示出宽广的线性区间和优异的准确度。所有校正曲线的线性都非常好,R2 大于0.99。
TSQ 8000 GC-MS/MS 也显示出非常好的离子比稳定性,适用于阳性样品的确认。所有化合物的离子比,哪怕是在LOQ 浓度下,RSD% 都低于4%。基于GC-MS/MS 的亚硝胺检测方法的使用、建立,以及维护都很简单。哪怕是在分析新的未知物时,我们独有的AutoSRM 软件也能够自动找出并优化SRM 离子对和碰撞能。
基于本文所示的GC-MS/MS 方法,TSQ 8000 GC-MS/MS 能够准确可靠地测出真实样品中的亚硝胺含量。
本文所述的利用TSQ 8000 GC-MS/MS 进行食品中的亚硝胺检测的GC-MS/MS 方法可以直接用于常规的食品安全控制。本方法使用的标准GC-MS/MS 三重四极杆仪器也被广泛应用于常规食品安全控制的其他领域,例如杀虫剂、POPs,或多环芳烃。本方法检测迅速,能够支持高样品通量,并且提供的结果具有非常高的灵敏度和精确度。本方法使用常规的电子轰击源进行离子化并实现低浓度的亚硝胺定量,我们推荐将本方法作为前述使用液态CI试剂的化学离子化的离子阱方法的高产出的替代方案。


参考文献
[1] Robert K. Boyd, Cecilia Basic, Robert A. Bethem, Trace Quantitative Analysis by Mass Spectrometry, 2008 John Wiley& Sons, Ltd.
[2] Material Safety Data Sheet NDMA.
[3] Agency for Toxic Substances & Disease Registry, Public Health Statement for n-nitrosodimethylamine, 1989, http://www.atsdr. cdc.gov/toxprofiles/phs141. html
[4] Richard A. Scanlan, Nitrosamines and Cancer, Linus Pauling institute, http://lpi.oregonstate.edu/f-w00/nitrosamine.html .
[5] Mario M. Mangino and Richard A. Scanlan, N-Nitrosamines in Beer, N-Nitroso Compounds, ACS Symposium Series, Vol. 174,1981, Chapter 17, 229–245.
[6] Munch, J.W., Bassett, M.V. Method 521: Determination of nitrosamines in drinking water by solid phase extraction and capillary column gas chromatography with large volume injection and chemical ionization tandem mass spectrometry (MS/MS) (Version 1.0) U.S. Environmental Protection Agency.
[7] Raymond E. March, Richard J. Hughes, Quadrupole Storage Mass Spectrometry, 2nd Ed., John Wiley & Sons 1989.
[8] AOAC Official Method 982.11, 2000.
[9] Introducing AutoSRM, Thermo Fisher Scientific, Technical Brief No. AB52298, 2012.
[10] Thermo Scientific TSQ 8000 Triple Quadrupole GC-MS/MS Instrument Method, Thermo Fisher Scientific, Technical Brief No. AB52299, 2012.





