FDA2024年度新药盘点及相关动物模型的介绍
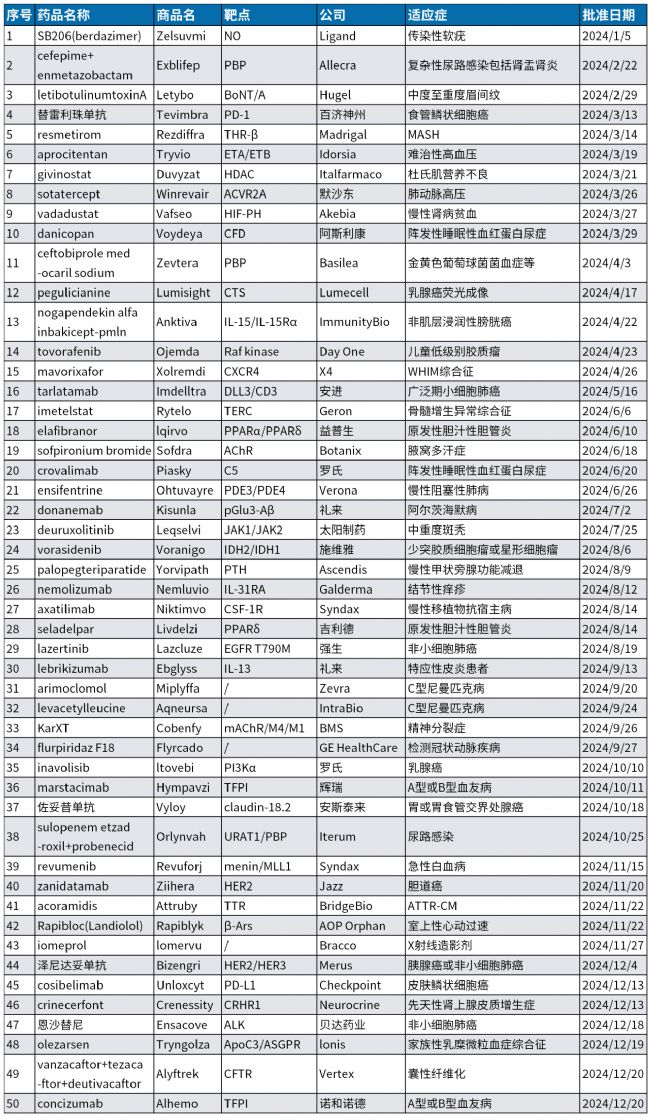
2024年已尘埃落定,这一年对医药行业算不上好,裁员、缩减研发管线的新闻未曾间断,一些创新药企倒在资本寒冬之下,黯然退场。但我们可以看到医药人并没有停下创新的脚步,无论是颠覆性的创新型疗法,还是小众的罕见病领域,在2024年都有里程碑式的突破发生。具体来说,2024年美国食品药品监督管理局(FDA)的药品评价研究中心(CDER)批准了50种新药,涵盖34种化药和16种生物药,这一数字超过了近10年的平均水平。具体来看,小分子药物以32种的数量稳居首位;蛋白质类药物有16种,其中新型单克隆抗体10种,双特异性抗体3种;此外,还有2种寡核苷酸类药物获批。
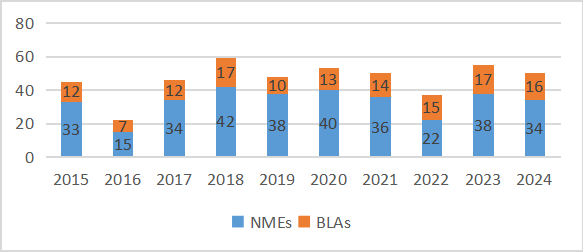
图1. 2015-2024年FDA新药批准概况
按治疗领域划分,癌症依然是药物开发的核心领域。2024年,共有15种新药获批用于癌症治疗,其中不乏多款First in Class药物。皮肤病学和非恶性血液学领域各有6种新药获批,并列第二。此外,FDA还批准了5种新的心脏病治疗药物。与往年相比,神经学和传染病领域的新药获批数量有所下降。以下是对部分具有代表性的新药的简要回顾。
首款MASH药物
Resmetirom(Rezdiffra)
非酒精性脂肪性肝炎(Nonalcoholic steatohepatitis,NASH),也称为代谢功能障碍相关脂肪性肝炎(metabolic dysfunction–associated steatohepatitis,MASH),是一种进行性肝病,其特征是存在5%或以上的肝脂肪变性并伴有肝细胞损伤和炎症。

图2. Resmetirom结构式
由于目前还没有被批准的治疗MASH的药物治疗方法,因此Resmetirom于2024年3月获得FDA的加速批准。Resmetirom 是一种甲状腺激素受体-beta(THR-β)激动剂,促进脂肪自噬和肝脏脂肪酸β-氧化,从而减少肝脏脂肪。
首款精神分裂药物
Xanomeline & trospium(Cobenfy)
目前的抗精神病药物主要通过阻断多巴胺受体来控制幻觉、妄想及其他精神分裂症症状。然而,这些药物常常伴随严重的运动和代谢副作用,可能导致心脏病和糖尿病的风险。Karuna与百时美施贵宝联合开发的固定剂量组合药物Xanomeline与trospium chloride,作为一种双重M1/M4毒蕈碱型乙酰胆碱受体(mAChR)激动剂,为精神分裂症提供了一种创新的治疗方案。
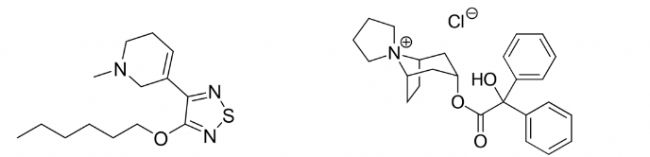
图3. xanomeline(左)及trospium(右)结构式
首款肿瘤浸润淋巴细胞疗法
Lifileucel(Amtagvi)
当机体检测到肿瘤时,一部分淋巴细胞会迁移至肿瘤部位并发起攻击,但患者体内的肿瘤浸润淋巴细胞(TIL)数量通常不足,无法有效遏制癌细胞的生长。而在治疗血液瘤上效果显著的CAR-T,对于实体瘤往往没有较好的疗效。在这样的背景下,基于肿瘤浸润淋巴细胞的TIL疗法,凭借对抗实体瘤展现出的巨大优势站在了舞台的聚光灯下。
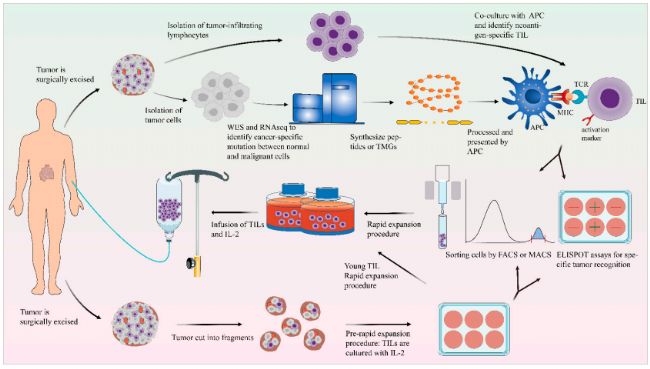
图4. TIL制备方案概述[1]
Lifileucel的治疗原理是从患者体内获取肿瘤组织,提取其中的TIL,在体外利用IL-2细胞因子刺激TIL扩增后,将其回输至患者体内,从而更有效地杀伤肿瘤细胞。不过,作为全球首款实体瘤TIL疗法,lifileucel的价格高达370万一针。
八款癌症治疗突破性疗法
Tarlatamab(Imdelltra)
2024年5月16日,FDA批准了由Amgen公司开发的双特异性T细胞接合疗法tarlatamab上市。该疗法适用于治疗那些在接受铂类化疗或化疗后病情仍出现进展的广泛期小细胞肺癌(ES-SCLC)成人患者。Tarlatamab是首个且目前唯一一个以DLL3为靶点的双特异性T细胞接合疗法,能够激活患者自身的T细胞,从而攻击表达DLL3的肿瘤细胞。
Imetelstat(Rytelo)
2024年6月6日,FDA批准由Geron Corporation所开发的端粒酶抑制剂imetelstat上市,用于治疗低危骨髓增生异常综合征(LR-MDS)患者的输血依赖性贫血。Imetelstat 是首个获FDA批准的端粒酶抑制剂。
Vorasidenib(Voranigo)
2024年8月6日,FDA批准了Servier开发的IDH1/2抑制剂vorasidenib上市,用于治疗12岁及以上伴有易感IDH1或IDH2突变的2级少突胶质细胞瘤或星形细胞瘤患者,包括儿童和成人。Vorasidenib成为FDA批准的首个且唯一一款用于治疗IDH突变2级胶质瘤的靶向药物。
Zolbetuximab(Vyloy)
2024年10月18日,FDA批准了由Astellas开发的Claudin 18.2靶向抗体zolbetuximab上市,用于治疗难治性转移性胃癌和胃食管交界(GEJ)腺癌患者。Zolbetuximab成为首个获FDA批准的Claudin 18.2靶向抗体疗法。
Revumenib(Revuforj)
2024年11月15日,FDA批准了Syndax开发的menin抑制剂Revumenib上市,用于治疗伴有赖氨酸甲基转移酶2A基因(KMT2A)易位的复发或难治性(R/R)急性白血病患者,包括成人及一岁及以上的儿童患者。Revumenib成为首个且目前唯一获批的menin抑制剂。
Zanidatamab(Ziihera)
2024年11月20日,FDA批准了Zymeworks开发的HER2双特异性抗体Zanidatamab上市,用于治疗既往接受过治疗的不可切除或转移性HER2阳性(HER2+,标准为IHC3+)胆道癌(BTC)成人患者。Zanidatamab成为首款获批上市的HER2双特异性抗体。
Zenocutuzumab(Bizengri)
2024年12月4日,FDA批准了Merus N.V.开发的新型双特异性抗体Zenocutuzumab,用于治疗携带NRG1基因融合的晚期、不可切除或转移性非小细胞肺癌(NSCLC)和胰腺癌。Zenocutuzumab成为首个且目前唯一一个适用于NRG1融合阳性NSCLC或胰腺腺癌患者的疗法。
Cosibelimab(Unloxcyt)
2024年12月13日,FDA批准了Checkpoint Therapeutics开发的PD-L1靶向抗体cosibelimab,用于治疗转移性皮肤鳞状细胞癌(cSCC)或不适合治愈性手术或放疗的局部晚期cSCC成年患者。Cosibelimab成为首个且目前唯一一个获得FDA批准用于此适应症的程序性死亡配体-1(PD-L1)阻断抗体。
2024年这些上市的新药让我们感受到了创新的加速,不断涌现新型的疗法让更是革新了我们对既往治疗的认识,这给无数的病人带来了新的选择。但对于我们医药行业从业者来讲,面对的就是一个越来越卷的研发环境,这时候如果有一款合适的动物模型,就能让我们在临床前的研发阶段节约时间,占据主动!
南模生物相关动物模型
南模生物专业从事模式动物开发20余年,拥有900多种靶点人源化的小鼠模型,400多种基因修饰细胞系及数十种药物/手术诱导的动物模型,可以助力肿瘤、代谢、炎症、神经等各领域的新药研发,部分模型信息见下表:
点此查看南模生物部分靶点人源化模型
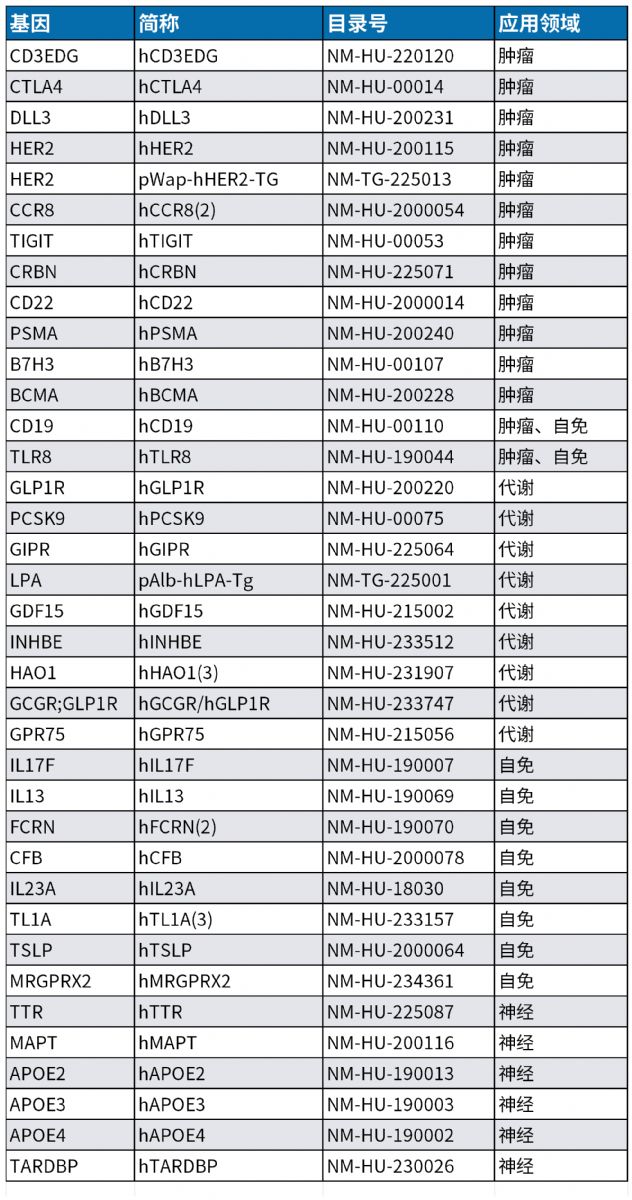
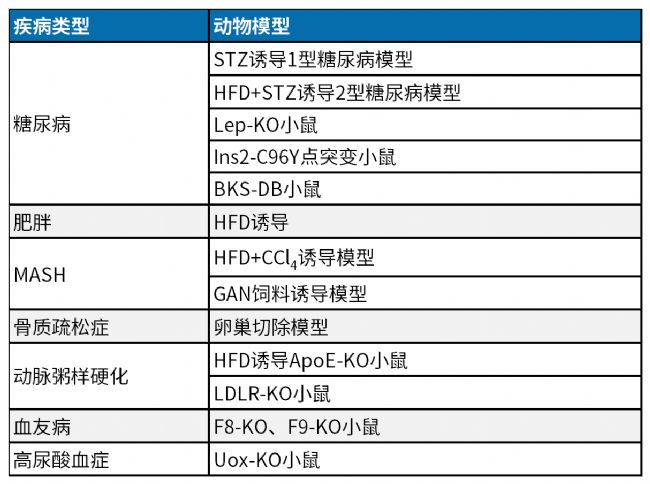
点此查看南模生物部分炎症/自免疾病模型
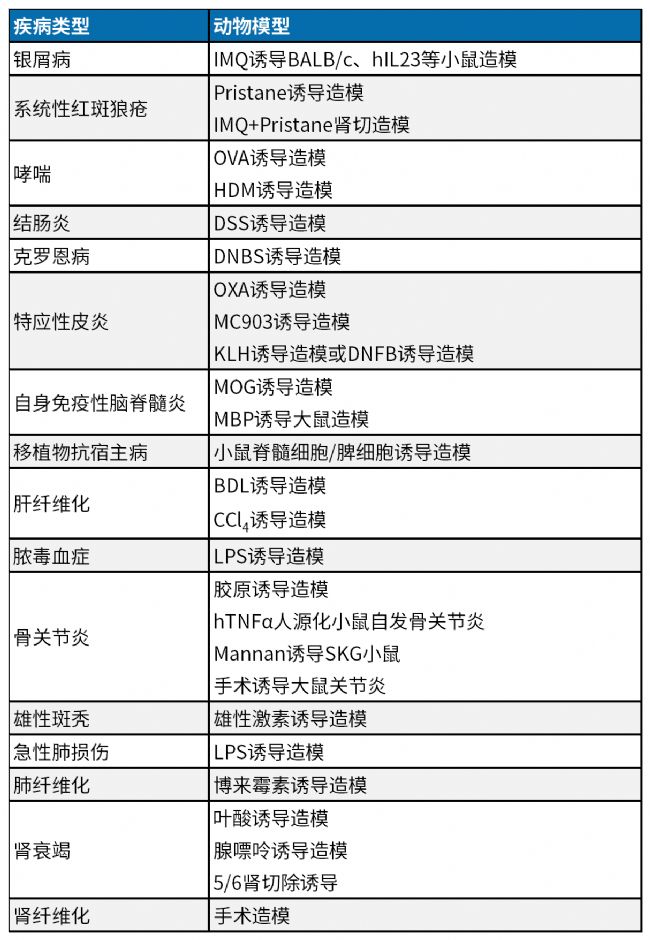
点此查看南模生物部分神经系统疾病模型
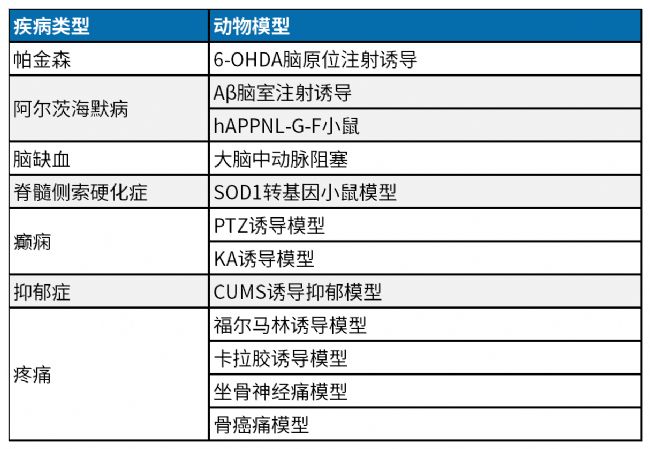
附表1
点此查看2024年批准新药
若您有相关需求,欢迎拨打400-728-0660热线或于南模生物微信公众号在线咨询,我们的专业团队将竭诚为您服务!
Reference:
[1] Zhao Y, Deng J, Rao S, et al. Tumor Infiltrating Lymphocyte (TIL) Therapy for Solid Tumor Treatment: Progressions and Challenges. Cancers (Basel). 2022;14(17):4160. Published 2022 Aug 27. doi:10.3390/cancers14174160
关于我们
上海南方模式生物科技股份有限公司(Shanghai Model Organisms Center, Inc.,简称"南模生物"),成立于2000年9月,是一家上交所科创板上市高科技生物公司(股票代码:688265),始终以编辑基因、解码生命为己任,专注于模式生物领域,打造了以基因修饰动物模型研发为核心,涵盖多物种模型构建、饲养繁育、表型分析、药物临床前评价等多个技术平台,致力于为全球高校、科研院所、制药企业等客户提供全方位、一体化的基因修饰动物模型产品解决方案。





