植物暗箱系统助力揭示辣椒中的蛋白CaCIPK13参与抗寒防御的机制
本项研究从辣椒中分离出一个冷诱导基因CaCIPK13,沉默CaCIPK13会降低对冷胁迫的耐受性;同时在CaCIPK13高表达的番茄植株中观察到了相反的表型:增强了对冷胁迫的耐受性,并含有更多的花青素和更高的ROS清除酶活性。

西北农林科技大学巩振辉教授团队近年来在高水平学刊发表了一系列关于辣椒抗性的论文,该研究得到了国家自然科学基金项目的资助。
博士生马潇为第一作者,在“Journal of Experimental Botany”期刊发表了“The CBL-interacting protein kinase CaCIPK13 positively regulates defence mechanisms against cold stress in pepper ”,该博士生的一系列成果令人印象深刻。
CaCIPK13蛋白:团队先从辣椒中分离出一个冷诱导的CIPK基因,命名为CaCIPK13,它编码一487个氨基酸的蛋白质。CaCIPK13是一个典型的CIPK家族成员,具有保守的NAF基序,由天冬酰胺、丙氨酸和苯丙氨酸组成。CaCIPK13蛋白位于细胞核和质膜中。
VIGS沉默分析:CaCIPK13 沉默会导致辣椒对冷胁迫的敏感性增强,丙二醛含量、H2O2累积和电解质渗漏增加;花青素含量降低,过氧化氢酶、过氧化物酶、超氧化物歧化酶活性降低。与空载体对照相比,CaCIPK13沉默的叶片中,低温和花青素相关基因的转录水平明显下降。反之,通过培育转基因番茄植株,过表达CaCIPK13可增加花青素含量和活性氧清除酶的活性,从而提高耐寒性。
此外,通过Y2H分析/BIFC实验/LCI分析,证明CaCIPK13 与 CaCBL1/6/7/8 存在相互作用,揭示CaCIPK13 通过CBL-CIPK 信号系统正向调控辣椒的耐寒性。
要点分析
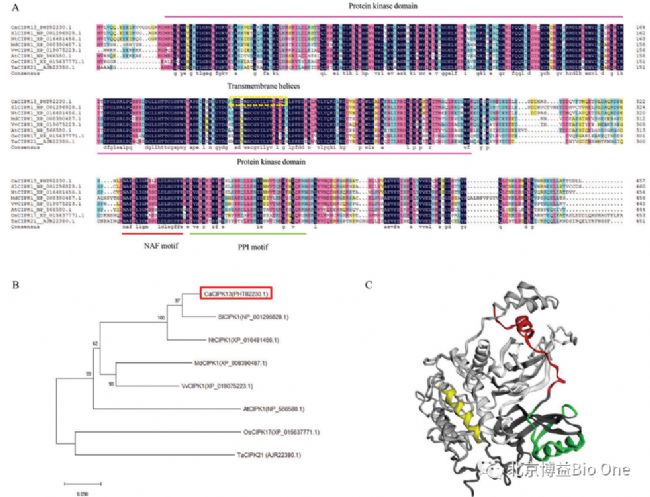
要点一:CaCIPK13的序列和系统进化分析
CaCIPK13 与 SlCIPK1 、NtCIPK1 、 MdCIPK1 和 VvCIPK1 同属一个亚群,与SlCIPK1 的关系最为密切(图 1B)。通过同源建模预测的CaCIPK13晶体结构如图 1C所示,重要特征用不同颜色标出,其中跨膜螺旋为黄色,NAF基序为红色,PPI基序为绿色。
要点二:CaCIPK13的表达模式和亚细胞定位
CaCIPK13是被冷胁迫逐渐诱导的(图 2A)。对辣椒'P70'中的表达模式进行了qRT-PCR 分析。在冷胁迫下,CaCIPK13的表达量升高,并在12小时后达到峰值(62.4 倍;图 2B)。在茎、根、叶、花、绿果和红果等组织中都检测到了CaCIPK13的转录水平。空间表达显示,CaCIPK13 在叶片(7.5 倍)和花朵(6.4 倍)中的表达量较高,其次是根(2.9 倍)和茎(1.0 倍,相较对照组),而在绿果(0.9 倍)和红果(0.6 倍)中的表达量较低(图 2C)。利用农杆菌GV3101将带有GFP蛋白的CaCIPK13 载体瞬时表达在烟叶表皮细胞中,空的GFP蛋白分布于整个细胞,CaCIPK13蛋白则分布于细胞核和质膜中(图2D)。

要点三:沉默CaCIPK13可降低辣椒的抗寒性
从阴性对照和CaCIPK13沉默植株中选择生长一致的幼苗进行冷胁迫,12小时后,CaCIPK13 沉默的植株严重枯萎(图3B)。测量PSII的最大光化学效率( Fv/Fm ) ( 图 3C ), 冷处理后 ,CaCIPK13沉默植株的 Fv/Fm 降低(图 3D),并且膜损伤指数REL 增加了(图 3E)。

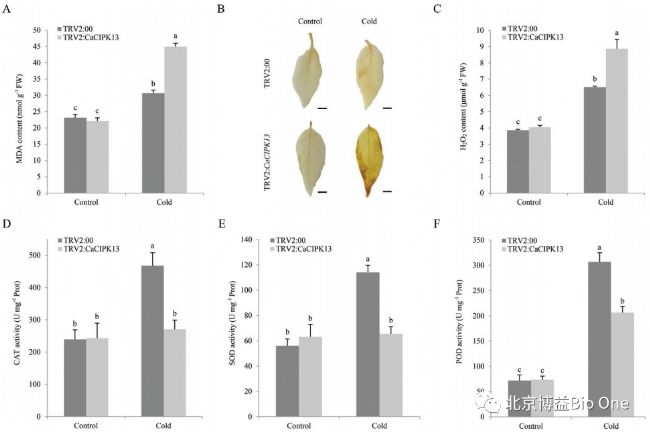
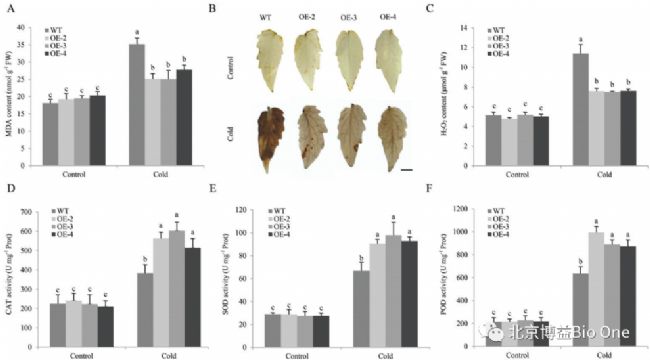
冷胁迫下,CaCIPK13沉默植株膜损伤指数MDA含量也有所增加,CaCIPK13沉默叶片比对照积累了更多的 H2O2(图 4B, C),对照植株的 CAT、SOD 和 POD 活性高于CaCIPK13沉默的植株(图 4D-F)。
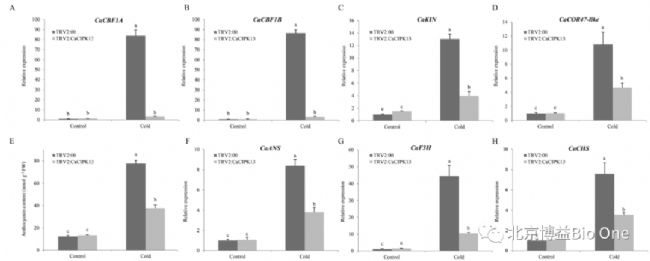
沉默CaCIPK13可降低冷诱导基因的表达(图 5A-D)。低温处理 4 d后,对照植株的花青素含量高于CaCIPK13沉默的植株(图 5E)。与花青素生物合成有关的基因 CaANS 、 CaF3H 和CaCHS 在CaCIPK13沉默植株中下调(图 5F-H)。
要点四:CaCIPK13在番茄中的过表达可增强耐寒性
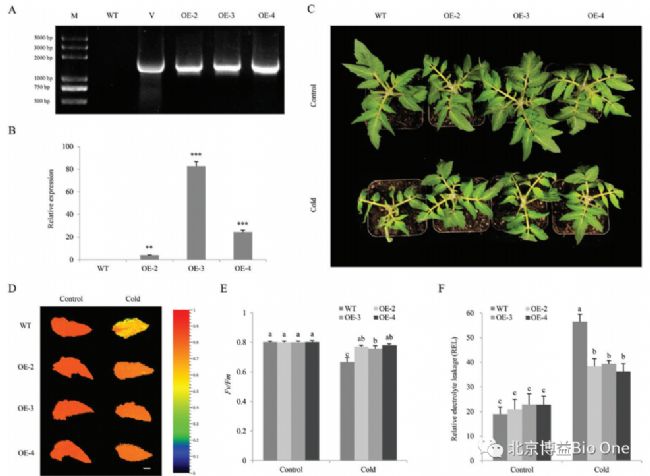
三个 CaCIPK13表达量较高的转基因番茄T3株系(OE-2、OE-3 和 OE-4)(图 6A、B)。与 OE-2 株系相比,OE-3 和 OE-4 株系的 CaCIPK13表达量更高(图 6B)。在冷胁迫下,OE 株系和 WT 株系都表现出枯萎,但 WT株系的枯萎更为严重(图 6C)。CaCIPK13过表达植株对冷胁迫的耐受性增强。对 PSII 最大光化学效率的分析表明,WT 叶片的 Fv/Fm 大大降低(图 6D、E)。在正常条件下,WT 和 OE 植物的 REL 没有差异。冷胁迫导致 WT 植株 REL数值比 OE 植株更高(图 6F)。
MDA 含量的变化趋势与 REL 相同(图 7A)。H2O2含量也有类似的变化趋势。冷处理后,与OE叶片相比,WT植物的叶片被DAB 深染成棕色(图 7B, C)。与 WT 相比,OE 植物在冷胁迫后 CAT、POD 和SOD 的活性大大提高(图 7D-F)。
同时,与 WT 植株相比,低温相关基因 SlCBF1、SlCBF2、SlCBF3、SlKIN 和 SlCOR47-like 在 OE 中的表达上调幅度更大(图 8A-E)。花青素含量的测定显示,冷处理 4 d 后,OE植株的花青素含量增加(图 8F)。分析了冷胁迫下花青素相关基因(SlANS、SlF3H和 SlCHS )的转录水平,与 WT相比,过表达CaCIPK13 的植株在冷胁迫下的花青素相关基因(SlANS、SlF3H 和 SlCHS)表达量更高,特别是在高表达CaCIPK13的OE-3系中,花青素相关基因表达是最高的(图 8G-I)。

要点五:CaCBL1/6/7/8-CaCIPK13的相互作用对Ca2+有依赖
当在含有 X-α-gal 的 SD/-Leu/-Trp/-His/-Ade 培养基上进行筛选时,只有 CaCIPK13 与 CaCBL1/6/7/8 生长良好并变成蓝色(图 9A)。为了验证CaCIPK13 和 CaCBL1/6/7/8 之间的相互作用,进一步进行了BiFC分析。在烟草叶片表皮细胞中,观察到黄色荧光信号出现在质膜(图 9B)。

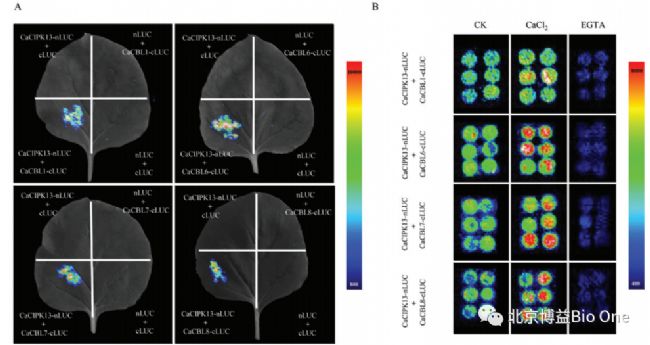
随后的 LCI 结果显示:CaCIPK13与 CaCBL1、CaCBL6、CaCBL7 和 CaCBL8 发生相互作用(图 10A)。考虑到 CaCBLs 和 CaCIPK13 参与钙信号传导,CaCl2 和 EGTA 处理分别促进和抑制 Ca2+ 。与正常情况相比,CaCl2 处理时发光信号增强,而 EGTA处理时发光信号减弱(图 10B)。结果证实,CaCIPK13 与 CaCBL1/6/7/8 之间的相互作用依赖于Ca2+。
小编作为设备方法学的关注者,在此罗列了有关分析方法:
(1)CaCIPK13和 CaCBLs之间的酵母双杂交(Y2H)分析:为了确定CaCIPK13和9个CaCBLs之间的关系,用特定引物扩增CaCIPK13的CDS,并将其克隆到pGBKT7-BD 载体的NdeI 和 SalI 位点之间。将pGBKT7- 53 与pGADT7-T 的融合作为阳性对照,而pGBKT7-lam 与 pGADT7-T的融合作为阴性对照。将融合的 pGBKT7-BD 和 pGADT7-AD构建物共转入 Y2H Gold 菌株,在SD/-Leu/-Trp上进行筛选,之后接种在含有 X-α-gal 和ABA的培养基ASD/-Leu/-Trp/- His/-Ade中, 30℃下培养3-5 d。
(2)双分子荧光互补(BiFC):利用荧光显微镜,使用荧光蛋白(YFP、RFP)标签,活体内验证 CaCIPK13 和 CaCBL1/6/7/8 之间的相互作用。CaCIPK13的CDS被克隆到 pUC-pSPYNE载体的 BamHI 和XhoI 位点之间,将CaCBL1、CaCBL6、CaCBL7和CaCBL8的序列克隆到pUC-pSPYCE载体的BamHI和XhoI位点之间。
(3)萤火虫荧光素酶互补成像(LCI)分析:用荧光素报告基因,再次确认CaCIPK13和CaCBL1/6/7/8 之间的相互作用。通过特异性引物扩增CaCIPK13和CaCBLs(CaCBL1、CaCBL6、CaCBL7、和CaCBL8)的CDS,并分别克隆到 pCAMBIA-nLUC 和 pCAMBIA-cLUC 中。利用低温CCD-暗箱系统(Lumazone)检测生物发光,曝光时间8分钟。将叶圆片置于含有 CaCl2 (20 mM) 或 EGTA (20mM) 的琼脂培养基中24小时,用来促进或抑制 Ca2+信号。
非常感谢西北农林科技大学研究团队的工作成果,让我们有机会学习与分享。
原文信息:The CBL-interacting protein kinase CaCIPK13 positively regulates defence mechanisms against cold stress in pepper
作者:Xiao Ma,Zhen-Hui Gong et al.
单位:College of Horticulture, Northwest A&F University, Yangling, Shaanxi, P. R. China
期刊:Journal of Experimental Botany
DOI:https://doi.org/10.1093/jxb/erab505
在本实验中低温CCD-植物暗箱系统(Lumazone),是由Bio-one成像事业部提供服务和售后;如有兴趣,请与我们联系:应用和售后支持:13811399984,13910490152,13910490151
邮箱:13910490407@139.com
关于北京博益伟业仪器有限公司北京博益Bio-one成立于2004年,一直专注于生物样本库建设、植物活体分子标记成像系统、三维活体小动物荧光断层成像技术、大分子与细胞膜表面受体相互作用等领域,致力于为科研用户提供更新的技术与服务。自2006年,我们开始参与农业种子基因库与临床样本库的设计与施工,积累了13年的4°C、-20°C、-80°C、液氮温区库等管理与维护经验;同时,自2008年开始,成像事业部追踪最新的活体成像技术,不断完善细胞-组织-活体的成像解决方案。欲了解上述领域内更多最新的技术文献与资讯,欢迎您关注此公众号或访问本司官网http://www.bio-one.cn
联系电话:010-64841721/1727,64842355/2356,58294864/4669,13810818543
E-mail:13810818543@139.com





