糖基化蛋白的分离纯化
蛋白质糖基化
蛋白糖基化的两个主要类型是N-糖基化(聚糖结合到天冬酰胺)和O-糖基化(聚糖结合到丝氨酸或苏氨酸),糖基化修饰的聚糖种类繁多。一般来说,N-多聚糖附着在由Asn-X-Ser/Thr组成的特定氨基酸序列基序上,X可以是除脯氨酸外的任何氨基酸。O-多聚糖与丝氨酸或苏氨酸相连,没有任何特定的氨基酸序列基序,此外,N-聚糖有一个共同的核心结构,由GlcNAc2Man3组成,而O-聚糖则有多个核心结构。蛋白糖基化分析的目的是确定聚糖基,被修饰的蛋白质,或结合的位点。在一般情况下,糖基化分析,可以使用三种不同的方法,概述如图1 A:化学或酶解后对释放的聚糖本身的分析,胰蛋白酶消化后对糖肽的定性,或完整的糖蛋白中对聚糖的定性。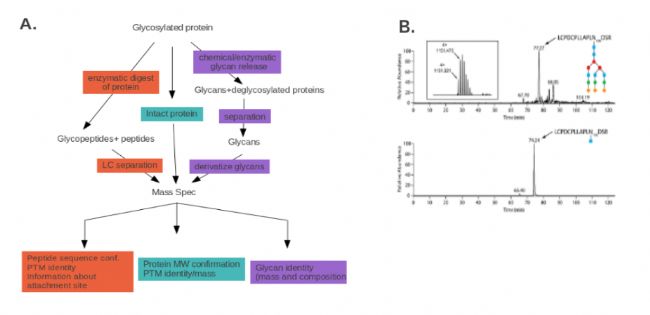 图 1. 糖基化可通过质谱测定,以确定特定的修饰聚糖
图 1. 糖基化可通过质谱测定,以确定特定的修饰聚糖
A, 糖基化的质谱测定有三种常用方法:检测完整的蛋白多糖,检测胰蛋白酶消化的产物,或检测释放的和分离的聚糖。 B, LC-MS检测小牛血清胎球蛋白,表明 Cc5细菌培养的(下图)相比于未经处理的(上图)胎球蛋白的糖基化变化。用胰蛋白酶消化胎球蛋白,然后用LC-MS分析。蓝色正方形代表GlcNAc,红色和绿色的圆形代表Man和Gal, 橙色钻石形代表
糖基化蛋白的鉴定方法
聚糖分析,可以用质谱分析,有时并用高效液相色谱法。糖蛋白首先经过酶(肽N糖苷酶A或F)或化学(hydazinolysis)方法释放糖基。然后LC/MS直接分析释放的低聚糖。或者,酶或化学裂解产生可以还原型末端被标上荧光标记,然后通过一些可能的HPLC方法,如亲水作用色谱,分析荧光标记的聚糖。
虽然上述方法能提供特定聚糖的信息,但是这些信息不能鉴定出带有特定修饰的蛋白质,也不能鉴定出糖基化的结合位点。为了获得此信息,就要进行蛋白内切酶裂解(如胰蛋白酶消化),LC/MS或HILIC-MS/MS分析糖肽。这种方法提供的信息是带有特定聚糖分子的所有蛋白质,或者是目标蛋白中聚糖的结合位点 [20] 。例如,图6B,是 Cc5细菌培养对特定胎球蛋白残基的糖基化状态的影响,分析方法是胰蛋白酶消化后,用LC-MS检测。
最后,对于有些糖肽,完整蛋白的质谱分析可以提供蛋白质的身份鉴定及其糖基化状态的数据。然而,这种方法取决于糖肽的生化特性,提供的数据的分辨率水平通常低于前述两种方法。
糖基化蛋白的分离纯化
由于硼酸反应的专一性,硼酸盐亲和材料近年来受到越来越多的关注。已证实硼酸盐亲和材料可以有效分离包括糖蛋白在内的含顺式二羟基结构的化合物。硼酸分子与糖链上的顺式二羟基结构在碱性条件下形成环酯,该生成物在酸性条件下容易水解,反应原理如图2所示。基于该可逆反应,可利用硼酸盐亲和材料选择性检测分离富集糖基化蛋白。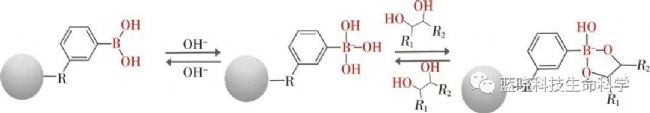
图2:硼酸亲和层析分离糖基化蛋白的原理
蛋白糖基化的两个主要类型是N-糖基化(聚糖结合到天冬酰胺)和O-糖基化(聚糖结合到丝氨酸或苏氨酸),糖基化修饰的聚糖种类繁多。一般来说,N-多聚糖附着在由Asn-X-Ser/Thr组成的特定氨基酸序列基序上,X可以是除脯氨酸外的任何氨基酸。O-多聚糖与丝氨酸或苏氨酸相连,没有任何特定的氨基酸序列基序,此外,N-聚糖有一个共同的核心结构,由GlcNAc2Man3组成,而O-聚糖则有多个核心结构。蛋白糖基化分析的目的是确定聚糖基,被修饰的蛋白质,或结合的位点。在一般情况下,糖基化分析,可以使用三种不同的方法,概述如图1 A:化学或酶解后对释放的聚糖本身的分析,胰蛋白酶消化后对糖肽的定性,或完整的糖蛋白中对聚糖的定性。
 图 1. 糖基化可通过质谱测定,以确定特定的修饰聚糖
图 1. 糖基化可通过质谱测定,以确定特定的修饰聚糖A, 糖基化的质谱测定有三种常用方法:检测完整的蛋白多糖,检测胰蛋白酶消化的产物,或检测释放的和分离的聚糖。 B, LC-MS检测小牛血清胎球蛋白,表明 Cc5细菌培养的(下图)相比于未经处理的(上图)胎球蛋白的糖基化变化。用胰蛋白酶消化胎球蛋白,然后用LC-MS分析。蓝色正方形代表GlcNAc,红色和绿色的圆形代表Man和Gal, 橙色钻石形代表
糖基化蛋白的鉴定方法
聚糖分析,可以用质谱分析,有时并用高效液相色谱法。糖蛋白首先经过酶(肽N糖苷酶A或F)或化学(hydazinolysis)方法释放糖基。然后LC/MS直接分析释放的低聚糖。或者,酶或化学裂解产生可以还原型末端被标上荧光标记,然后通过一些可能的HPLC方法,如亲水作用色谱,分析荧光标记的聚糖。
虽然上述方法能提供特定聚糖的信息,但是这些信息不能鉴定出带有特定修饰的蛋白质,也不能鉴定出糖基化的结合位点。为了获得此信息,就要进行蛋白内切酶裂解(如胰蛋白酶消化),LC/MS或HILIC-MS/MS分析糖肽。这种方法提供的信息是带有特定聚糖分子的所有蛋白质,或者是目标蛋白中聚糖的结合位点 [20] 。例如,图6B,是 Cc5细菌培养对特定胎球蛋白残基的糖基化状态的影响,分析方法是胰蛋白酶消化后,用LC-MS检测。
最后,对于有些糖肽,完整蛋白的质谱分析可以提供蛋白质的身份鉴定及其糖基化状态的数据。然而,这种方法取决于糖肽的生化特性,提供的数据的分辨率水平通常低于前述两种方法。
糖基化蛋白的分离纯化
由于硼酸反应的专一性,硼酸盐亲和材料近年来受到越来越多的关注。已证实硼酸盐亲和材料可以有效分离包括糖蛋白在内的含顺式二羟基结构的化合物。硼酸分子与糖链上的顺式二羟基结构在碱性条件下形成环酯,该生成物在酸性条件下容易水解,反应原理如图2所示。基于该可逆反应,可利用硼酸盐亲和材料选择性检测分离富集糖基化蛋白。

图2:硼酸亲和层析分离糖基化蛋白的原理





