食管鳞状细胞癌中相关成纤维细胞促进癌细胞侵袭和巨噬细胞迁移
在全球范围内,食道癌是第七大常见癌症。食管癌由两种主要的组织学类型组成,包括食管鳞状细胞癌(ESCC)和食管腺癌(EAC)。ESCC发生的重要危险因素包括饮酒、吸烟、高淀粉饮食等,但具体机制尚不清楚。
肿瘤微环境(TME)可以促进肿瘤进展。TME包括各种基质细胞,例如癌症相关成纤维细胞(CAFs),肿瘤相关巨噬细胞(TAMs)、其他非恶性细胞,和细胞外成分(细胞因子、生长因子、细胞外基质等)。CAFs通过介导肿瘤增殖、迁移和侵袭的激活,以及诱导血管生成、刺激转移等在肿瘤进展中起关键作用。CAFs可能来源于骨髓源性间充质干细胞(MSCs)、常驻成纤维细胞、内皮细胞、脂肪细胞和上皮细胞。α-平滑肌肌动蛋白(αSMA)和成纤维细胞活化蛋白(FAP)是CAFs的代表性细胞标志物,其表达升高与几种癌症的预后较差有关。研究表明,CAFs通过与TME的其他基质成分(如TAMs)相互作用间接促进肿瘤进展。
在日本神户大学医学研究科团队先前的一项研究中,表征了ESCC中CAFs的肿瘤促进能力和免疫抑制表型的机制。此外,在MSCs和ESCC细胞之间进行共培养测定,发现共培养的MSCs中FAP表达增加。这些FAP阳性MSCs,实验将其定义为CAF样细胞,通过分泌C-C基序趋化因子配体2(CCL2)和白细胞介素-6(IL-6)来促进ESCC细胞和巨噬细胞的迁移能力,并诱导巨噬细胞的M2极化。然而,CAFs、M2极化巨噬细胞(所谓的TAMs)和ESCC细胞之间的相互作用尚未详细阐明。
为了探索CAFs增强ESCC进展的机制,该团队在体外通过将MSCs与ESCC细胞共培养来建立CAF样细胞,通过cDNA微阵列分析比较了单培养MSCs和CAF样细胞之间的基因表达谱,并表征了CAF样细胞对ESCC细胞和巨噬细胞的影响。此外,确定了ESCC微环境中CAF样细胞促进肿瘤作用的可能关键参与者,这些细胞可能被用作ESCC治疗的潜在靶点。

MSCs 和CAF样细胞对PAI-1的表达
通过间接共培养法评估CAFs在ESCC微环境中的功能(图1 a)。在与三种TE-系列ESCC细胞:TE-8、TE-9、TE15细胞共培养的MSCs中诱导FAP的mRNA和蛋白表达水平。接下来将与TE-8、TE-9和TE-15细胞共培养的MSCs分别定义为CAF样细胞:CAF8、CAF9和CAF15细胞(图1 a)。通过比较单培养MSCs和CAF样细胞的基因表达谱,在CAF9中确定了110个上调的基因和128个下调的基因。热图显示了CAF9中上调基因中高表达的前50个基因(图1 b)。不同细胞组中CAF9和CAF15的基因表达模式最为相似。单培养的MSCs具有与CAF样细胞不同的表达模式。
在这项研究中,重点研究了丝氨酸蛋白酶抑制剂E1(SERPINE1),这是CAF样细胞中上调且高表达的基因之一(图1 b)。通过qRT-PCR证实了SERPINE1 mRNA以及IL6、CCL2和CXCL12 mRNA在CAF样细胞中的高表达水平(图1 c)。CAF样细胞分泌的PAI-1(纤溶酶原激活物抑制剂-1,由SERPINE1编码)的浓度明显高于单培养的MSCs(图1 d)。ELISA的结果验证了ESCC细胞,特别是TE-8和TE-9细胞中PAI-1的分泌(图1 d)。
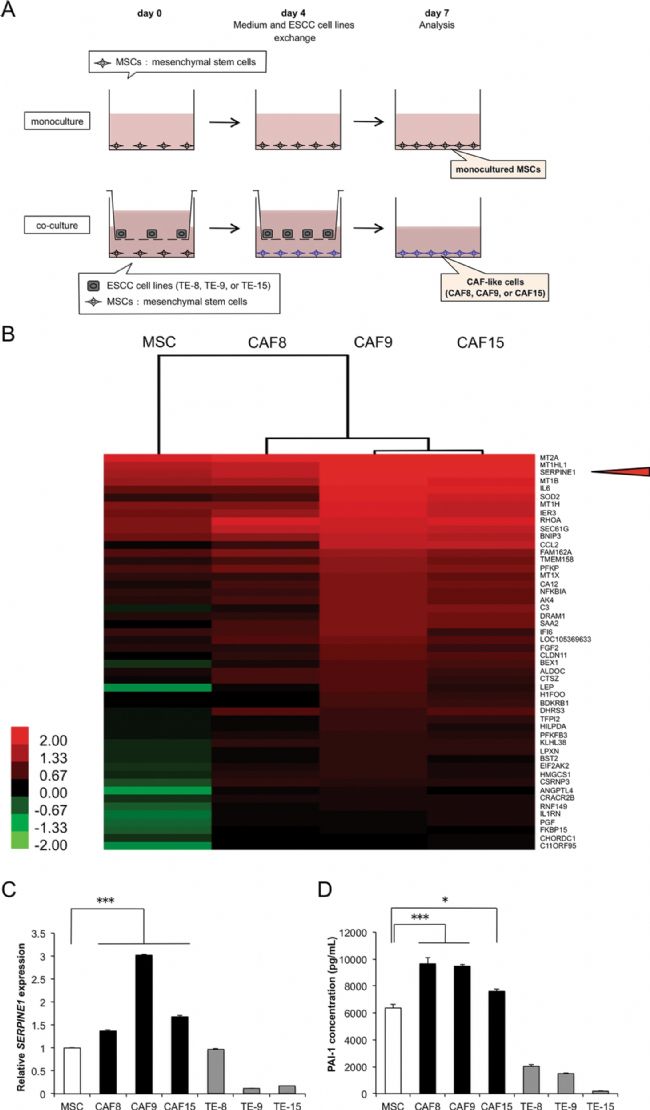
图1 PAI-1在CAF样细胞中被诱导表达和分泌
针对PAI-1的中和抗体抑制CAF样细胞诱导的ESCC细胞迁移
与CAF样细胞CAF8、CAF9和CAF15细胞共培养,分别显著诱导了3种TE-系列ESCC细胞TE-8、TE-9和TE-15细胞的迁移和侵袭能力(图2 a、b)。添加针对PAI-1的中和抗体显著抑制了与CAF样细胞共培养的ESCC细胞的迁移和侵袭能力(图2 c、d)。
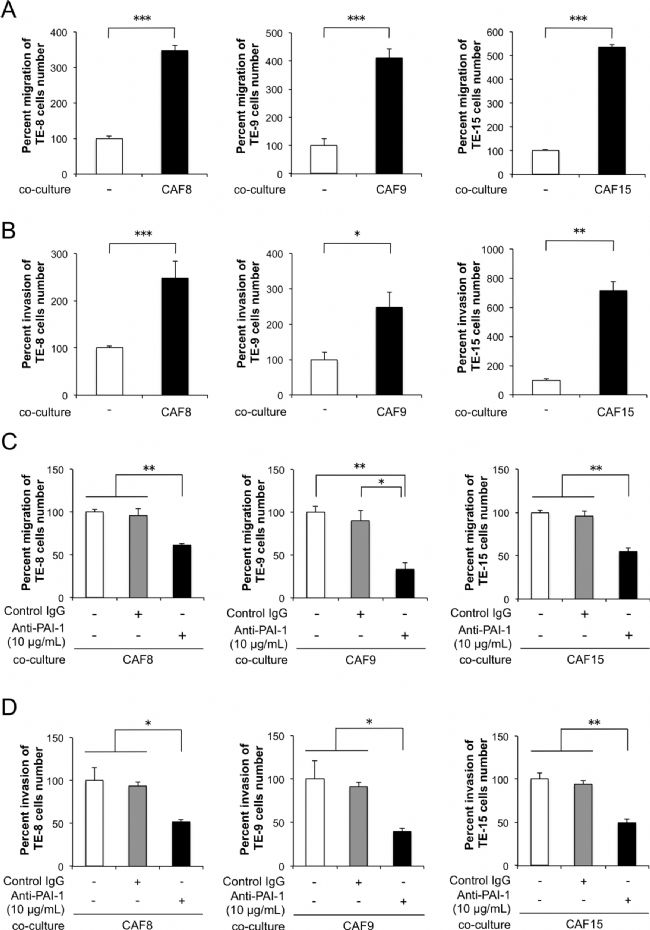
图2 CAF样细胞分泌的PAI-1促进ESCC细胞的迁移和侵袭
PAI-1通过激活Akt和Erk1/2信号通路诱导ESCC细胞的迁移和侵袭
使用RT-PCR和蛋白质印迹法确认了PAI-1受体LRP1在三个TE-系列ESCC细胞中的表达(图3 a、b)。为了研究PAI-1对ESCC细胞表型和信号通路的影响,将rhPAI-1应用于TE-8、TE-9和TE-15细胞。rhPAI-1显著促进了ESCC细胞的迁移和侵袭能力(图3 c、d)。此外,rhPAI-1促进TE-8和TE-9细胞的迁移。rhPAI-1在处理10或30分钟后增加p-Akt(Ser473 / Thr308)和p-Erk1/2水平(图3 e)。PI3K抑制剂LY294002和MEK1/2抑制剂PD98059抑制了rhPAI-1处理的ESCC细胞中迁移和侵袭的诱导(图3 f、g)。
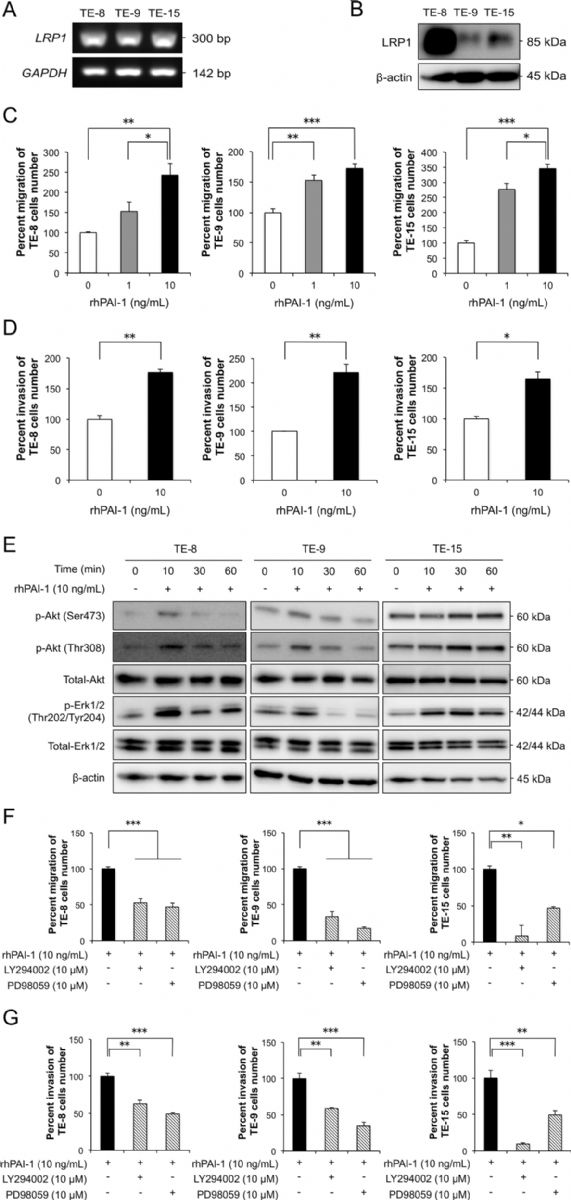
图3 PAI-1通过激活Akt和Erk1/2信号通路促进 ESCC 细胞的迁移和侵袭
PAI-1促进ESCC细胞的迁移和侵袭,并通过LRP1激活信号通路
为了阐明PAI-1是否通过LRP1影响ESCC细胞的表型和信号传导,实验通过RNA干扰抑制了三个TE-系列ESCC细胞中的LRP1 mRNA。结果表明,敲低ESCC细胞中LRP1显著抑制了rhPAI-1诱导的迁移和侵袭。在ESCC细胞中LRP1敲低后,p-Akt和p-Erk1/2水平降低。
PAI-1通过LRP1激活Akt和Erk1/2信号通路诱导巨噬细胞的迁移和侵袭
实验通过与上述相同的方法证实了PAI-1对巨噬细胞的影响。与CAF样细胞共培养显著诱导巨噬细胞的迁移和侵袭。针对PAI-1的中和抗体显著抑制了CAF样细胞诱导的巨噬细胞迁移和侵袭。使用RT-PCR和蛋白质印迹证实了LRP1在巨噬细胞中的表达。研究发现rhPAI-1显著促进了巨噬细胞的迁移和侵袭能力,观察到rhPAI-1在处理10分钟后增加了巨噬细胞中的p-Akt和p-Erk1/2水平。然而,rhPAI-1不影响巨噬细胞的M2极化。LY294002和PD98059抑制了rhPAI-1诱导的巨噬细胞迁移和侵袭能力。接下来,通过RNA干扰抑制巨噬细胞中的LRP1 mRNA,发现巨噬细胞中LRP1的敲低抑制了rhPAI-1诱导的迁移和侵袭。PAI-1诱导的p-Akt和p-Erk1/2的水平也因巨噬细胞中LRP1的敲低而降低。
PAI-1 和 LRP1 表达水平与 ESCC 患者的临床病理因素和预后相关
为了明确PAI-1和LRP1的表达水平是否与ESCC患者的临床病理因素相关,实验对69例人ESCC组织中的PAI-1和LRP1进行了免疫组织化学分析。根据PAI-1在基质细胞中的免疫反应性和LRP1在癌细胞(CA)或基质细胞(ST)中的免疫反应性将ESCC组织分为高表达组和低表达组(图4 a、b、c、d),并通过双重免疫荧光确认包括CD204+ TAMs在内的基质细胞在人ESCC组织中表达LRP1(图4 e)。研究发现PAI-1在肿瘤基质中的高表达水平与肿瘤浸润深度、αSMA和FAP的高表达水平以及大量浸润的CD204+巨噬细胞密切相关。LRP1(CA)的高表达水平与FAP的高表达水平和大量浸润的CD204+巨噬细胞显著相关。LRP1(ST)的高表达水平与性别、肿瘤浸润深度、αSMA和FAP的高表达水平以及大量浸润的CD204+巨噬细胞显著相关。
接下来,分析了PAI-1和LRP1表达的预后值。分析显示,PAI-1和LRP1(ST)高表达水平的患者无病生存期(DFS)明显较短,LRP1(CA)高表达水平的患者肿瘤特异性生存期(CSS)明显较短。PAI-1、LRP1(CA)或LRP1(ST)表达对患者的总生存期没有显著影响。
接下来,根据PAI-1和LRP1(CA)免疫反应性评分的组合将患者分为三组。PAI-1和LRP1(CA)均高表达的患者与PAI-1和LRP1(CA)均低表达的患者相比,DFS和CSS显著缩短。与PAI-1和LRP1(CA)表达水平低的患者相比,PAI-1或LRP1(CA)高表达水平的患者DFS明显较短。同样,根据PAI-1和LRP1(ST)免疫反应性评分的组合将患者分为三组。PAI-1和LRP1(ST)表达水平高的患者与PAI-1和LRP1(ST)表达水平低的患者相比,DFS和CSS表达水平明显较短。此外,PAI-1和LRP1(ST)高表达水平的患者与PAI-1或LRP1(ST)低表达水平的患者相比,DFS明显较短。
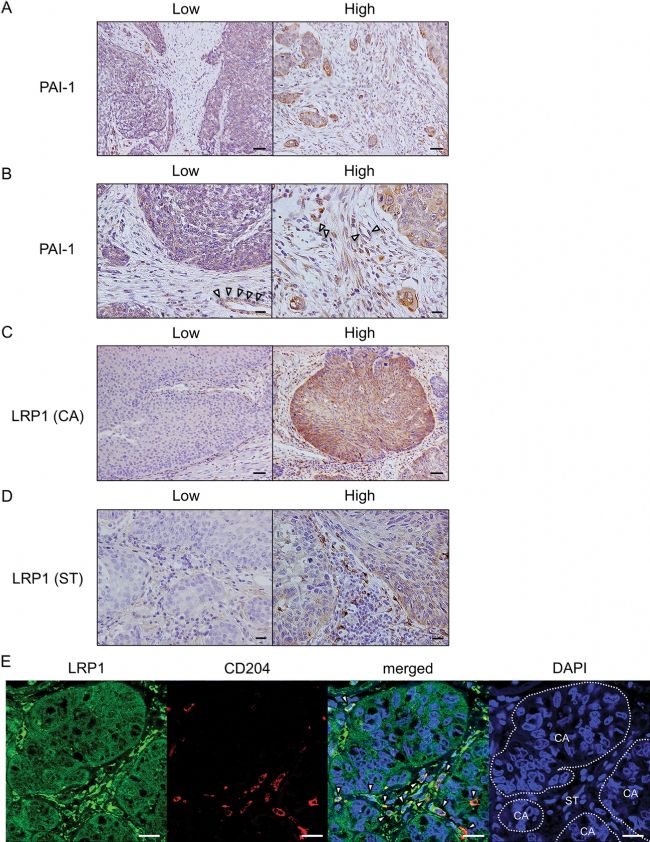
图4 PAI-1和LRP1在人ESCC组织中的表达
总之,该研究证明了来源于CAFs的PAI-1通过与LRP1相互作用,通过Akt和Erk1/2的磷酸化促进了ESCC细胞和巨噬细胞的迁移和侵袭。CAFs 中的 PAI-1 是 ESCC 患者的潜在预后因素。因此,靶向PAI-1/LRP1轴可能是ESCC的一种治疗方法。
参考文献:Sakamoto H, Koma YI, Higashino N, Kodama T, Tanigawa K, Shimizu M, Fujikawa M, Nishio M, Shigeoka M, Kakeji Y, Yokozaki H. PAI-1 derived from cancer-associated fibroblasts in esophageal squamous cell carcinoma promotes the invasion of cancer cells and the migration of macrophages. Lab Invest. 2021 Mar;101(3):353-368. doi: 10.1038/s41374-020-00512-2. Epub 2020 Dec 12. PMID: 33311557; PMCID: PMC7892342.
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用!





