来自富含ACE2细胞制备的膜纳米颗粒阻断SARS-CoV-2的感染途径
由严重急性呼吸系统综合征冠状病毒(SARS-CoV-2)引起的2019新冠肺炎(COVID-19)在全球范围内爆发,已感染超8500万人,导致超过180万人死亡,发热、咳嗽、肌痛或疲劳是COVID-19患者的常见症状。一旦病情恶化,急性呼吸窘迫综合征、呼吸衰竭、败血症和急性肾损伤是常见的致命并发症。全球COVID-19大流行的持续发展,需要开发针对SARS-CoV-2的治疗方法。
2021年3月18日,中国人民解放军陆军军医大学放射损伤及放射复合伤的发病机制与防治研究团队合作在ACS NANO杂志(IF=15.498)发表了题为“Membrane Nanoparticles Derived from ACE2- Rich Cells Block SARS-CoV-2 Infection”的研究论文。

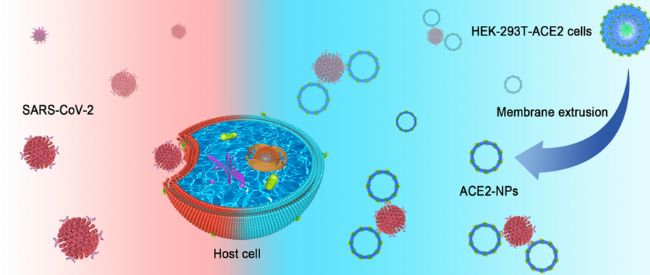
王成副教授,王少博,陈银为第一作者,赵景宏教授、王军平教授为通讯作者,开发出了一种由富含ACE2的细胞膜制成的纳米粒子,可以阻止SARS-CoV-2的刺突,从而阻止感染。
该研究发现了针对2019冠状病毒病(COVID-19)SARS-CoV-2的治疗方法。病毒致病过程包括细胞联合、膜穿透、内体逃逸、病毒粒子脱壳和基因组复制,致病机理SARS-CoV-2附着在细胞膜上是COVID-19发病的第一步。这一过程可归因于病毒spike (S)蛋白,该蛋白可被蛋白酶降解为S1和S2亚基。S1负责识别宿主受体,S2介导病毒融合进入细胞质。ACE2是SARS-CoV-2 S1的主要受体,介导病毒进入宿主细胞。研究人员发现,从富含ACE2的细胞中制备的纳米膜颗粒(NPs)具有有效阻断SARS-CoV-2感染的能力。以高表达ACE2的人胚肾239t细胞膜为材料,采用挤压法制备NPs。这些被称为ACE2- NPs的纳米材料表面含有265.1 ng/mg ACE2,并以剂量依赖的方式作为诱捕新冠病毒(S1蛋白)的诱饵,导致HK-2人肾小管上皮细胞中病毒配体的招募减少。除了影响受体的识别,S1移位到细胞质中,通过减少视神经萎缩的表达和增加细胞色素c的释放来诱导细胞凋亡,ACE2-NPs也抑制了这一作用。进一步研究表明,ACE2-NPs能有效抑制SARS-CoV-2假病毒进入宿主细胞,并在体内外阻断病毒感染。本研究确定ACE2-NPs膜纳米是SARS-CoV-2的拮抗剂,丰富了现有的抗病毒药物库,为COVID-19的治疗提供了可能性。
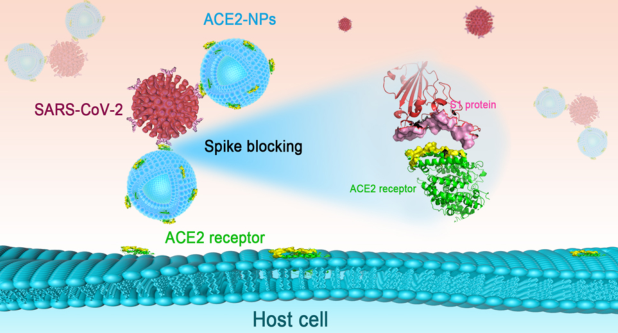
图1. ACE2-NPs的制备及功能示意图
研究结果
1.ACE2-NPs的制备与鉴定
通过Western blotting分析人类细胞系(包括HEK-293T细胞、HEK-293T-ACE2细胞、HK-2近端小管细胞、Caco-2肠上皮细胞和A549 II型肺细胞)中的ACE2水平。HEK-293T-ACE2在携带病毒受体方面优于其他细胞系(图2a)。与ACE2在肠上皮细胞中的位置一致,ACE2多位于HEK-293T-ACE2细胞的细胞膜上(图2b)。然后对细胞进行反复冷冻和解冻以分离膜,再用超声破碎膜,然后用挤压方法制备ACE2-NPs。制备的NPs携带ACE2,不含残留的核酸(图2c)。透射电镜(TEM)显示,与使用相同尺寸的聚碳酸酯膜制备的红细胞衍生NPs一样,ACE2-NPs的尺寸约为100 nm,在溶液中具有较好的分散性(图2d)。动态光散射(DLS)检测到,带负电荷的纳米材料的平均直径为169 nm(图2e)。采用相同方法制备的HEK-293T衍生NPs (293T-NPs)的ACE2含量低于ACE2-NPs(图2f、2g),这是进一步功能评估的先决条件。

图2. ACE2在人体细胞中的筛选及ACE2-NPs的鉴定
2.ACE2-NPs对S1募集到敏感细胞的抑制作用
S1包含一个受体结合域(RBD),是ACE2的配体。我们将生物素修饰的RBD固定在链霉亲和素(SA)生物传感器上,并通过BLI测定其与NPs的相互作用。在相同浓度下,ACE2-NPs结合RBD多于293T-NPs(图3a)。随着S1附着在敏感细胞的表面,我们将细胞与10 μg/mL S1一起培养,无论有无NPs,ACE2-NPs显著减少了对S1的募集(基于膜蛋白),并且比293T-NPs更有效(图3b)。ACE2-NPs以剂量依赖的方式与RBD结合(图3a),与剂量依赖的S1一致。免疫荧光显示S1吸附在ACE2-NPs上(图2c)。因此,ACE2-NPs处理后,HK-2细胞粘附的S1亚基较少(图3c)。随着病毒突变,一种由Gly (D614G)取代Asp614的S1变异在全球流行。这种突变SARS-CoV-2比野生型更具传染性。数据显示,D614G-S1与ACE2的亲和力为11.6 nM(图3d),与野生型S1与ACE2的亲和力相当(8.02 nM)。也就是说D614G突变病毒比祖先型更强的传染性不是由于受体的增强。D614G突变没有改变ACE2-NPs与S1的剂量依赖结合。ACE2-NPs仍然与D614G-S1结合和阻断D614G-S1的募集(图3e)时,比293T-NPs更有效。

图3. ACE2-NPs对S1招募的抑制作用
3.ACE2-NPs对S1诱导凋亡的抑制作用
S1位于HK-2的细胞膜和细胞质中(图3c)。蛋白质组学分析显示,SARS-CoV-2的单个蛋白质重塑宿主细胞的中心通路,导致代谢紊乱,包括线粒体功能障碍。SARS-CoV-2 S1可能影响受体识别功能以外的细胞代谢。通过基因(GO)分析确定线粒体组织和凋亡信号通路被富集(图4a)。线粒体组织的动态改变与细胞凋亡相关。OPA1是一种位于线粒体内膜的动力相关蛋白,它通过嵴重构而不依赖于线粒体融合来控制细胞凋亡。过表达OPA1通过抑制细胞色素c的释放和依赖细胞凋亡蛋白酶的激活来保护细胞避免凋亡。Western blotting(图4b)和RT-PCR反应(图4c,d)显示,S1和D614G-S1刺激都降低了OPA1的表达,促进了细胞色素c的释放和细胞凋亡蛋白酶3的激活。流式细胞实验证实S1和D614G-S1显著增加了HK-2细胞的凋亡(图4e)。ACE2-NPs处理可提高细胞OPA1水平,以剂量依赖的方式减少S1和D614G-S1引起的细胞凋亡。根据S1招募的差异,ACE2-NPs在抑制细胞凋亡方面优于293T-NPs。
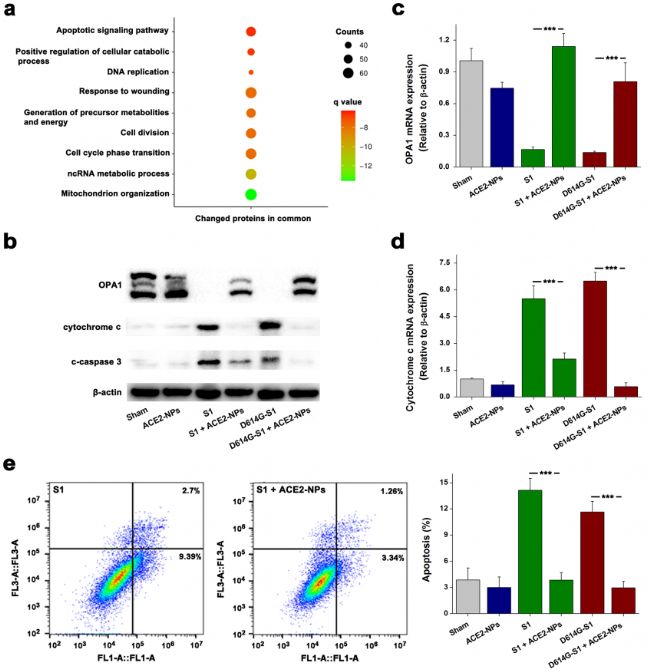
图4. ACE2-NPs对s1诱导细胞凋亡的抑制作用
4.ACE2-NPs的抗病毒作用
为了深入了解ACE2-NPs体外抗病毒特性,我们用含有荧光素酶报告系统的SARS-CoV-2S假病毒感染HK-2细胞。SARS-CoV-2与ACE2结合,通过跨膜蛋白酶丝氨酸2在S1/S2边界的蛋白水解进入宿主细胞。细胞内原蛋白转化酶也通过预激活病毒S蛋白促进SARS-CoV-2进入宿主。S假病毒在共孵育1小时后被HK-2细胞大量内吞(图5a)。ACE2-和293T-NP治疗均减少了病毒进入细胞。透射电镜显示,S假病毒被吸附在ACE2和293T-NPs上(图5b),形成类冠状病毒复合物。荧光素酶实验显示ACE2-NPs具有剂量依赖性的抗病毒活性(图5c)。ACE2-NPs的半数抑制浓度(IC50)低于293T-NPs (图5d)。
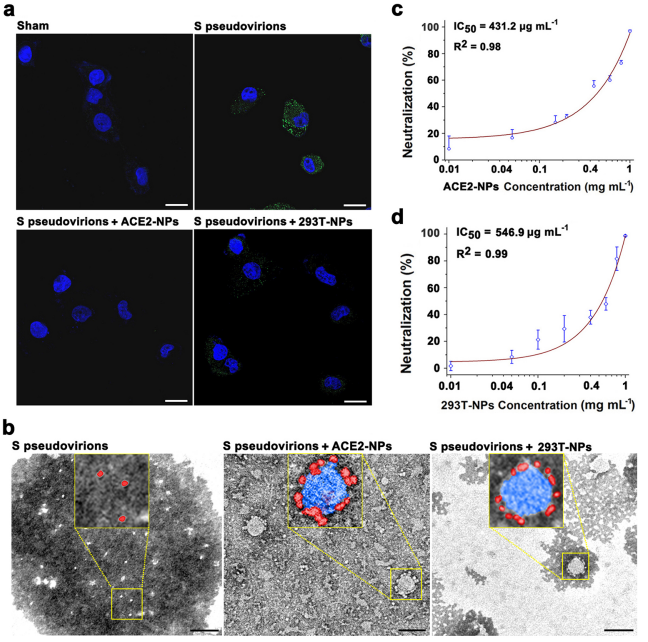
图5. ACE2-NPs的抗病毒活性评价
5.小鼠感染模型NPs的体内抗病毒特性
为了评估假病毒的小鼠感染模型NPs的体内抗病毒特性,将带有flag标记的ACE2腺病毒静脉注射给C57小鼠;然后给小鼠注射表达带有His-tag和NPs的绿色荧光蛋白的S假病毒颗粒(图6a)。被腺病毒感染的小鼠产生ACE2-Flag,导致对S假病毒敏感(图6b)。通过检测EGFP和His-tag验证假病毒的感染情况。我们发现EGFP在小鼠的肝脏(图6c)、肺(图6d)、肾脏(图6e)和脾脏中表达。NP治疗显著降低了病毒对所有器官的侵袭。通过Western blotting(图6b)和免疫荧光分析(图6f)发现,ACE2-NPs在阻断病毒方面比293T-NPs更有效,检测小鼠肺中的His标记进一步证实了这一点。

图6. ACE2-NPs对小鼠S假病毒感染的抑制作用
6.ACE2-NPs的生物相容性和生物分布
过表达膜受体不影响CMBNPs的生物相容性。我们不断增加ACE2-NPs的浓度与人脐静脉内皮细胞(HUVECs)孵育24小时发现,ACE2-NPs在剂量达500 μg/mL时不影响细胞存活。在体内评价中,C57小鼠静脉注射25 mg/kg ACE2-NPs。NPs在3小时后几乎从血液中清除(图7a)。荧光成像显示,ACE2-NPs主要分布在肝脏和肺部,可被3,3’-二十八氧杂环花青素高氯酸盐(DiO)检测(图7b)。ACE2-NP治疗对血液中的红细胞、白细胞(WBC)和血小板(PLT)计数和血红蛋白含量影响较小(图7c)。第一次注射后7天收集主要器官,包括心、肝、脾、肺和肾。苏木素和伊红(HE)染色未见组织病理改变(图7d),表明其在体内无毒性,为ACE2-NPs作为抗SARS-CoV-2纳米拮抗剂的应用奠定了良好的基础。
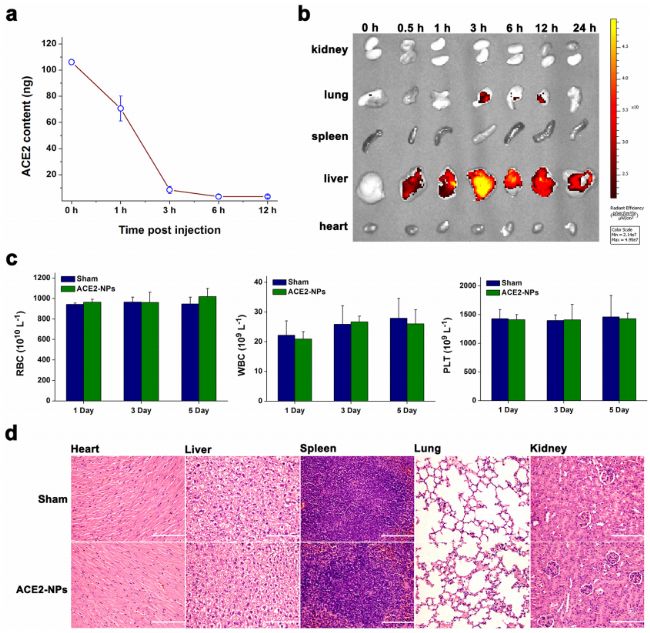
图7. ACE2-NPs的分布及毒性分析
研究结论
本研究制备了具有抗SARS-CoV-2活性的HEK-293T-ACE2细胞膜纳米材料,并对其进行了评价。ACE2-NPs中含有丰富的ACE2,这是SARS-CoV-2 S1的关键受体。通过竞争性抑制,ACE2-NPs与S1结合,并以剂量依赖的方式阻止病毒配体粘附人肾小管上皮细胞。由于S1的募集,ACE2-NPs将S假病毒粒子吸附在其表面,阻止病毒进入细胞质,从而保护宿主细胞免受病毒感染。ACE2-NPs也通过提高OPA1的表达和减少细胞色素c的释放来抑制S1诱导的细胞凋亡。
擎科助力:
本研究中用到的新冠假病毒LV-Spike-nCOV-EGFP和过表达腺病毒Adeno-ACE2为擎科生物提供。
更多新冠假病毒机制研究产品:
回复小编或联系service@tsingke.com.cn即刻开聊,下单可直接联系当地销售经理。
参考文献:
[1] Cheng Wang, Shaobo Wang, Yin Chen, etaL. Membrane NanoparticLes Derived from ACE2- Rich CeLLs BLock SARS-CoV-2 Infection. ACS Nano,2021.3.





