动物脑电极使用及手术指导
一、电极使用指导
1.1电极检查
电极固定在海绵中,便于安全装运和存储。对刚收到的电极应进行外观检查并确认是否完好。在透明包装盒未开封的情况下,肉眼或借助显微镜检查电极的整体外观,主要确定电极是否包装完好,电极在包装盒内是否岀现移动或脱落,导致电极丝被破坏掉。如果怀疑电极丝损坏了,可在50×或100×的显微镜下检查,检查包括电极丝整体整齐度、电极丝尖端是否出现折弯及涂覆层脱落现象。有以上情况的话及时拍照并给公司相关负责人员反馈。取电极时,一手捏着泡沫夹板,另一只手或镊子紧紧夹住着电极接口处,不能触碰电极尖端和表面。另外,只可使用带有刻度尺的显微镜对电极丝的直径进行测量,检查时切勿使用其他设备触碰到电极丝。
1.2灭菌
方法一,使用前采用气体灭菌,灭菌温度不能超过110℃。
方法二,电极尖端先在75%酒精中浸泡,切勿将电极尖端触碰到容器表面,然后用无菌水顺着露岀的电极尖端往下冲洗,避免酒精残留。对于硅胶材料的电极如柔性电极应尽量避免酒精长时间的接触,可使用无菌生理盐水浸泡消毒。
1.3阻抗值测量
a.阻抗测量仪上有正、负(参考)两个夹子,用1根金属棒探入生理盐水,负的夹子夹在这个金属棒上;
b.阻抗测试仪正的一端接在从电极端口段引出的接线端或插针上,将电极丝尖端浸入生理盐水液面以下2-3mm处,待仪表上的数值稳定后,进行读数并记录(微丝电极的测试频率通常为1000Hz)。
电极的阻抗值是一个范围,不同厂家选用的电极丝直径、材质、加工工艺都会导致做出的阻抗值不尽相同,因此应以最后能够采集到信噪比较高的信号为准
1.4存放电极
急性实验电极可以多次使用,从动物体内取出后的电极放在酒精液中浸泡一段时间(硅胶材质的电极不能使用酒精长时间浸泡),用注射器抽取生理盐水对电极丝的部位轻轻冲洗,将电极上残留的组织清洗干净。对于急性单电极(多通道阵列电极不适用),若尖端处沾有难以清洗的组织,可使蘸有酒精的棉球从电极尾部向尖端小心轻轻擦拭,此过程中切勿对电极丝受力或反向擦拭。最后用原包装盒内的海绵固定封装存放(勿将电极丝触碰到海绵),勿将电极存放于粉尘颗粒物较多的的环境中。
二、植入手术
2.1手术环境
手术室温度控制在21-25℃,气温较低时可使用加热装置来保证实验动物在手术中的体温维持在正常范围,电热丝加热垫会产生较大干扰噪音,在采集信号时应将其关掉。整个操作环境尽量保持无菌状态(可在无菌操作台中进行)。
2.2主要实验器械
1.1电极检查
电极固定在海绵中,便于安全装运和存储。对刚收到的电极应进行外观检查并确认是否完好。在透明包装盒未开封的情况下,肉眼或借助显微镜检查电极的整体外观,主要确定电极是否包装完好,电极在包装盒内是否岀现移动或脱落,导致电极丝被破坏掉。如果怀疑电极丝损坏了,可在50×或100×的显微镜下检查,检查包括电极丝整体整齐度、电极丝尖端是否出现折弯及涂覆层脱落现象。有以上情况的话及时拍照并给公司相关负责人员反馈。取电极时,一手捏着泡沫夹板,另一只手或镊子紧紧夹住着电极接口处,不能触碰电极尖端和表面。另外,只可使用带有刻度尺的显微镜对电极丝的直径进行测量,检查时切勿使用其他设备触碰到电极丝。
1.2灭菌
方法一,使用前采用气体灭菌,灭菌温度不能超过110℃。
方法二,电极尖端先在75%酒精中浸泡,切勿将电极尖端触碰到容器表面,然后用无菌水顺着露岀的电极尖端往下冲洗,避免酒精残留。对于硅胶材料的电极如柔性电极应尽量避免酒精长时间的接触,可使用无菌生理盐水浸泡消毒。
1.3阻抗值测量
a.阻抗测量仪上有正、负(参考)两个夹子,用1根金属棒探入生理盐水,负的夹子夹在这个金属棒上;
b.阻抗测试仪正的一端接在从电极端口段引出的接线端或插针上,将电极丝尖端浸入生理盐水液面以下2-3mm处,待仪表上的数值稳定后,进行读数并记录(微丝电极的测试频率通常为1000Hz)。
电极的阻抗值是一个范围,不同厂家选用的电极丝直径、材质、加工工艺都会导致做出的阻抗值不尽相同,因此应以最后能够采集到信噪比较高的信号为准
1.4存放电极
急性实验电极可以多次使用,从动物体内取出后的电极放在酒精液中浸泡一段时间(硅胶材质的电极不能使用酒精长时间浸泡),用注射器抽取生理盐水对电极丝的部位轻轻冲洗,将电极上残留的组织清洗干净。对于急性单电极(多通道阵列电极不适用),若尖端处沾有难以清洗的组织,可使蘸有酒精的棉球从电极尾部向尖端小心轻轻擦拭,此过程中切勿对电极丝受力或反向擦拭。最后用原包装盒内的海绵固定封装存放(勿将电极丝触碰到海绵),勿将电极存放于粉尘颗粒物较多的的环境中。
本手术操作以大鼠(体重250-300g)为例。
2.1手术环境
手术室温度控制在21-25℃,气温较低时可使用加热装置来保证实验动物在手术中的体温维持在正常范围,电热丝加热垫会产生较大干扰噪音,在采集信号时应将其关掉。整个操作环境尽量保持无菌状态(可在无菌操作台中进行)。
2.2主要实验器械

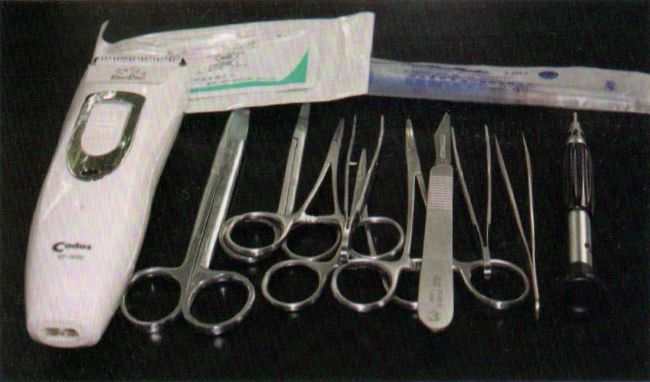
止血钳、镊子、手术剪刀(大剪刀及小剪刀)、缝合针线、手术刀柄和刀片、颅骨钻及钻头(0.8mm)、螺丝刀、电动剃、注射器等,所有的手术器械在使用前均需经过严格消毒处理。
2.3主要材料及药品试剂
无菌生理盐水、75%医用酒精、碘伏、酒精棉及棉签、脱毛膏、不锈钢微型螺丝钉(M1*2、M1*3,使用前应使用75%酒精充分浸泡清洗),牙科水泥粉、戊巴比妥钠溶液(1%,现配)、红霉素眼膏、利多卡因膏、三联抗生素、阿托品(1mg/mL)、地塞米松、卡洛芬等。
2.4手术操作步骤
2.4.1称重
将大小约20*20*20cm的盒子置于电子秤上,去皮,把大鼠放置在盒子内(抓大鼠时需带上防咬手套),读数。
2.4.2麻醉
麻醉对整个手术至关重要,其麻醉的稳定性直接影响到手术结果的好坏。若要获得更好的麻醉效果,建议使用异氟烷呼吸麻醉,但由于呼吸麻醉成本较高且麻烦,多数实验室还是使用注射麻醉,因此这里以注射麻醉为例。麻醉剂采用1%戊巴比妥钠溶液(戊巴比妥钠比水合氯醛麻醉更稳定,但容易产痰,需要备吸管帮助吸出痰),剂量为0.5m/100g(50mg/Kg)。腹腔注射前先对大鼠用异氟烷短暂麻醉,具体操作:将大鼠放进透明盒子中,此时将蘸有异氟烷的棉球丟入盒子内,密封,待大鼠安静不动,呼吸均匀(1次/秒)时取出。腹腔注射:将大鼠仰面朝向,提起一侧后肢,在大腿根与腹中线的中间位置刺入皮下,在皮下平行于腹中线推进针头3-5mm,再以45°角向腹腔内刺入,针尖通过腹肌后,无阻力,回抽无回流物,缓慢注入麻药。注射麻药后,对大鼠进行疼痛反射(掐尾端或后脚掌)和眼角膜反射来判断麻醉效果。在15min之后还未能完全麻醉的大鼠可适当补加0.2-0.5m的1%戊巴比妥钠溶液。若手术时间较长,应每隔1h检查大鼠麻醉状态,当出现疼痛反应时,应补加05m的1%戊巴比妥钠溶液。手术中,应将大鼠舌头从口的一侧拉出,为防止大鼠在麻醉过程中呼吸道出现过多分泌物导致窒息,可在麻醉过程中注射0.5m阿托品(1mg/m)。
2.4.3去毛
用左手将麻醉后的大鼠托住,右手手持电动剃逆着大鼠毛发的方向(从后往前)将头顶的毛发剃除,一般剃毛范围是两耳之间,前至两眼间,后至颈部始端。若要达到更好的干净度,可涂抹少量脱毛膏,使用后需要使用生理盐水清洗掉残余物。
2.4.4固定
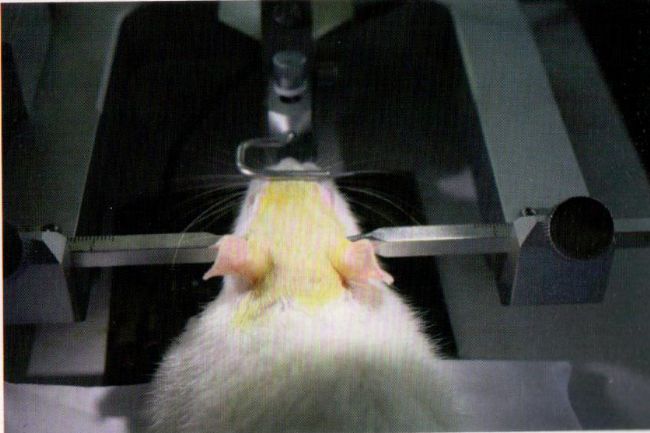
大鼠固定的好坏会直接影响到手术中信号采集的稳定性,甚至会影响到慢性植入后的效果。首先将一侧耳杆固定,找到大鼠耳道稍向前上方的骨性凹陷处(可以用手触摸到),将其中一侧的凹陷处贴在固定的耳杆上(提前涂抹少量利多卡因药膏可以避免耳杆对大鼠刺激),此时将另一侧耳杆也插入对应的位置,调节两侧耳杆长度,使之对称,固定紧耳杆。左右及上下轻轻移动大鼠的头部,避免出现松动及偏斜。在固定好大鼠耳杆后,还需将大鼠的上门齿固定。具体操作:将大鼠上门齿卡进门齿杆的槽内,下颌处于门齿杆的下方,然后下调两侧的眼眶固定杆,压紧并固定。适当调整各固定点,使得大鼠的整个颅骨面保持水平,从各个方向用力均不能移动大鼠的头部。最后在大鼠的眼部涂抹上红霉素眼膏或甘油,以防止手术灯的长时间照射造成眼部损伤以及保持眼睛的湿润。另外,要用圆头镊子将大鼠的舌头从口中一侧拉出,防止手术中出现窒息。
2.3主要材料及药品试剂
无菌生理盐水、75%医用酒精、碘伏、酒精棉及棉签、脱毛膏、不锈钢微型螺丝钉(M1*2、M1*3,使用前应使用75%酒精充分浸泡清洗),牙科水泥粉、戊巴比妥钠溶液(1%,现配)、红霉素眼膏、利多卡因膏、三联抗生素、阿托品(1mg/mL)、地塞米松、卡洛芬等。
2.4手术操作步骤
2.4.1称重
将大小约20*20*20cm的盒子置于电子秤上,去皮,把大鼠放置在盒子内(抓大鼠时需带上防咬手套),读数。
2.4.2麻醉
麻醉对整个手术至关重要,其麻醉的稳定性直接影响到手术结果的好坏。若要获得更好的麻醉效果,建议使用异氟烷呼吸麻醉,但由于呼吸麻醉成本较高且麻烦,多数实验室还是使用注射麻醉,因此这里以注射麻醉为例。麻醉剂采用1%戊巴比妥钠溶液(戊巴比妥钠比水合氯醛麻醉更稳定,但容易产痰,需要备吸管帮助吸出痰),剂量为0.5m/100g(50mg/Kg)。腹腔注射前先对大鼠用异氟烷短暂麻醉,具体操作:将大鼠放进透明盒子中,此时将蘸有异氟烷的棉球丟入盒子内,密封,待大鼠安静不动,呼吸均匀(1次/秒)时取出。腹腔注射:将大鼠仰面朝向,提起一侧后肢,在大腿根与腹中线的中间位置刺入皮下,在皮下平行于腹中线推进针头3-5mm,再以45°角向腹腔内刺入,针尖通过腹肌后,无阻力,回抽无回流物,缓慢注入麻药。注射麻药后,对大鼠进行疼痛反射(掐尾端或后脚掌)和眼角膜反射来判断麻醉效果。在15min之后还未能完全麻醉的大鼠可适当补加0.2-0.5m的1%戊巴比妥钠溶液。若手术时间较长,应每隔1h检查大鼠麻醉状态,当出现疼痛反应时,应补加05m的1%戊巴比妥钠溶液。手术中,应将大鼠舌头从口的一侧拉出,为防止大鼠在麻醉过程中呼吸道出现过多分泌物导致窒息,可在麻醉过程中注射0.5m阿托品(1mg/m)。
2.4.3去毛
用左手将麻醉后的大鼠托住,右手手持电动剃逆着大鼠毛发的方向(从后往前)将头顶的毛发剃除,一般剃毛范围是两耳之间,前至两眼间,后至颈部始端。若要达到更好的干净度,可涂抹少量脱毛膏,使用后需要使用生理盐水清洗掉残余物。
2.4.4固定
大鼠固定的好坏会直接影响到手术中信号采集的稳定性,甚至会影响到慢性植入后的效果。首先将一侧耳杆固定,找到大鼠耳道稍向前上方的骨性凹陷处(可以用手触摸到),将其中一侧的凹陷处贴在固定的耳杆上(提前涂抹少量利多卡因药膏可以避免耳杆对大鼠刺激),此时将另一侧耳杆也插入对应的位置,调节两侧耳杆长度,使之对称,固定紧耳杆。左右及上下轻轻移动大鼠的头部,避免出现松动及偏斜。在固定好大鼠耳杆后,还需将大鼠的上门齿固定。具体操作:将大鼠上门齿卡进门齿杆的槽内,下颌处于门齿杆的下方,然后下调两侧的眼眶固定杆,压紧并固定。适当调整各固定点,使得大鼠的整个颅骨面保持水平,从各个方向用力均不能移动大鼠的头部。最后在大鼠的眼部涂抹上红霉素眼膏或甘油,以防止手术灯的长时间照射造成眼部损伤以及保持眼睛的湿润。另外,要用圆头镊子将大鼠的舌头从口中一侧拉出,防止手术中出现窒息。






