植物成像应用文献:TuMV VPg通过与NdhM抑制叶绿体的防御作用

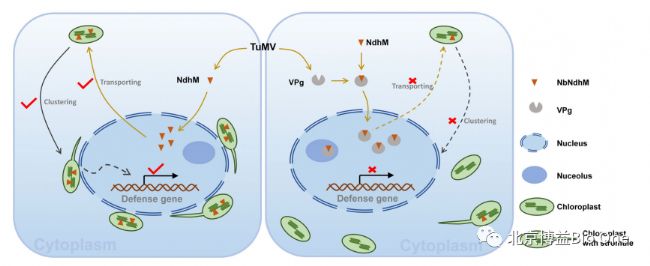
图1.NbNdhM抵抗TuMV侵染机制示意图
首先,作者通过对TuMV侵染后的本氏烟草进行转录组测序分析,发现NbNdhM基因的表达水平受病毒侵染的影响。并通过实验验证其过表达可以抑制TuMV的复制,而沉默会促进病毒侵染。其次,进一步证明了NbNdhM通过诱导核周叶绿体的聚集抵御TuMV侵染,并且与TuMV VPg进行相互作用。此外,研究还显示不同植物物种的NdhM与不同病毒的蛋白均存在相互作用,表明NdhM可能是病毒侵染植物的共同靶标。最后,作者发现TuMV VPg通过与NdhM的相互作用,改变NdhM的定位并增加核积累,干扰核周叶绿体的聚集,从而抑制叶绿体的防御作用。
本文要点
要点一:NbNdhM基因沉默/过表达实验
TuMV侵染初期会增加NbNdhM的表达水平,但随着侵染时间的延长,表达水平下调。研究人员利用植物活体成像系统(Lumazone sophia)可视化荧光蛋白标记的芜菁花叶病毒(TuMV-GFP)侵染程度。如图2b,c所示,在3天后,观察到感染植物叶片上出现TuMV-GFP的荧光。在4天后,NbNdhM沉默植株(TRV:NbNdhM)叶片上的荧光高于对照组(TRV:00),说明沉默NbNdhM后会促进TuMV侵染。图3a-c则证明了过表达NbNdhM可以抑制TuMV的侵染。
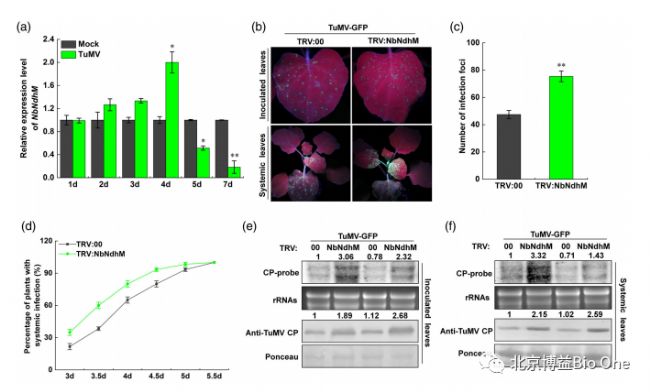
图2.沉默NbNdhM促进TuMV侵染
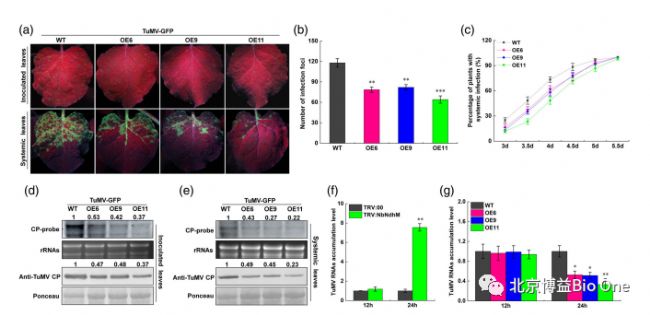
图3.过表达NbNdhM抑制TuMV侵染
要点二:NbNdhM诱导核周叶绿体聚集抵御TuMV侵染
过表达NbNdhM可以促进叶绿体围绕细胞核聚集,防御TuMV侵染。而沉默NbNdhM则会导致抑制这种聚集现象。
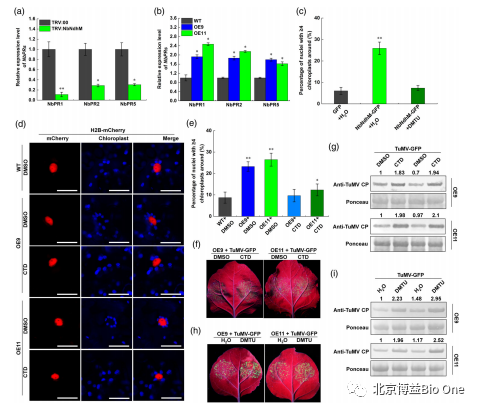
图4.NbNdhM诱导核周叶绿体聚集
要点三:TuMV蛋白VPg与NbNdhM的相互作用
作者通过酵母双杂交(Y2H)、荧光素酶互补成像(LCI)、免疫共沉淀(Co-IP)以及荧光互补实验(BiFC)等多种方法证明了TuMV蛋白VPg与NbNdhM的相互作用。
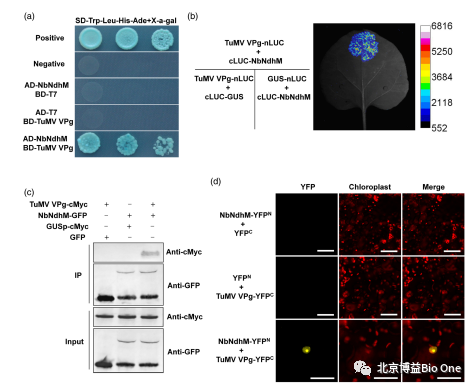
图6.TuMV VPg与NbNdhM相互作用
(a)Y2H实验,表明芜菁花叶病毒(TuMV)VPg与NbNdhM存在相互作用。将pGBKT7-53 + pGADT7-T共转化到酵母Y2HGold中作为阳性对照;pGBKT7 + pGADT7-NbNdhM,pGBKT7-TuMV VPg + pGADT7-T以及pGBKT7-Lam + pGADT7-T作为阴性对照。共转化的酵母在含有X-α-gal和AbA的选择培养基SD-Ade-His-Leu-Trp中,30℃下培养4-6天。
(b)LCI实验,表明TuMV VPg与NbNdhM存在相互作用。在荧光素存在的情况下,共表达cLUC-NbNdhM和TuMV VPg-nLUC产生了生物发光信号;β-葡萄糖苷酸酶(GUS)为非相互作用蛋白,作为阴性对照。使用Lumazone Sophia 2048B植物活体成像系统检测。
(c)Co-IP实验,表明TuMV VPg与NbNdhM存在相互作用。NbNdhM-GFP和TuMV VPg-cMyc在本氏烟草叶片中共表达。以空GFP、TuMV VPg-cMyc、NbNdhM-GFP和GUSp-cMyc的共表达作为阴性对照。
(d)BiFC实验,表明TuMV VPg与NbNdhM存在相互作用。NbNdhM的C端与YFP的N端片段融合,TuMV VPg与YFP的C端片段融合。
原文信息:Turnip mosaic virus impairs perinuclear chloroplast clustering to facilitate viral infection
作者:Jianping Chen,Fei Yan et al.
单位:Institute of Plant Virology,China
期刊:Plant, Cell & Environment
原文链接:https://doi.org/10.1111/pce.14157
技术应用
荧光素酶互补成像实验(LCI技术):将荧光素酶蛋白分为N端和C端2个功能片段, 即NLuc和CLuc。待测的2个目的蛋白分别与N-Luc和C-Luc融合。当2个目标蛋白相互作用时,NLuc和C-Luc紧密结合,恢复荧光素酶的催化活性,促使荧光素酶底物氧化而发光。通过植物活体成像系统检测生物发光的强度,从而对蛋白之间的相互作用进行定性和定量分析。此方法已被广泛应用于动植物相关领域的蛋白质互作研究。
植物活体成像系统(Lumazone)应用:高通量突变体筛选、逆境处理研究、生物节律、激素信号、蛋白互作等实验,以及甲基化和钙信号传导等极弱信号生物发光/荧光成像实验。
|
欢迎有兴趣了解Luamzone植物活体成像设备应用的研究团队与我们联系: |
联系电话:010-64841721/1727,64842355/2356,58294864/4669,13810818543
E-mail:13810818543@139.com





