肿瘤坏死因子(TnFAIP3)通过泛素化结合在类风湿关节炎疾病中的作用
A20,或肿瘤坏死因子α诱导蛋白3(TnFAIP3),是一种锌指泛素编辑抗炎酶,能够调节免疫反应和细胞凋亡。A20基因突变体和A20单倍体与几种自身免疫性和自身炎症性疾病有关1-4,包括类风湿性关节炎(RA)、系统性红斑狼疮(SLE)和银屑病关节炎5-7。利用动物模型进行的研究证实了A20在自身炎症和类风湿关节炎疾病的发病机制中的作用,并帮助确定了相关机制8-9。首先确定的是A20发挥抗炎作用的机制是通过抑制NF-κB的活性10。据报道,A20 的酶功能还能保护自身炎症,包括通过去泛素化受体相互作用蛋白激酶3(RIPK3)抑制坏死性下垂11 (图1)。
类风湿性关节炎(RA)是一种慢性自身免疫性疾病,以炎症性关节炎和多种全身症状为特征。在传统的改变病情抗风湿药(DMARDs)中加入免疫抑制生物制剂,改善了对 RA的治疗12。然而,目前尚无根治方法,其发病机制仍未被完全阐明。近年来,A20蛋白中的两个泛素结合结构域ZnF4和ZnF7,被证明是抑制炎症依赖性关节炎的关键9-13。本文将回顾揭示A20泛素结合在RA和相关关节炎疾病中的重要性的证据。
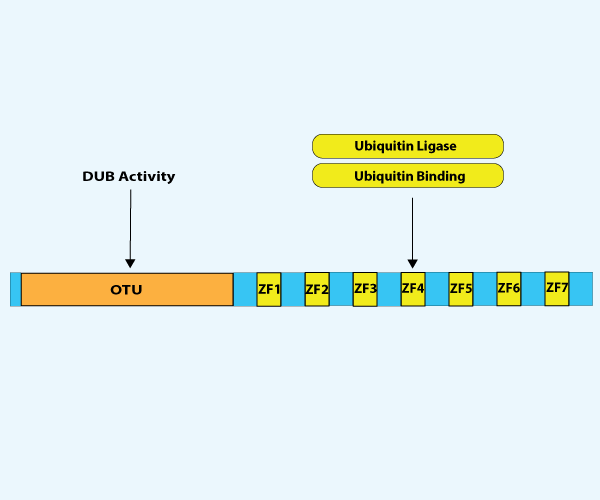
图1. A20的域结构。A20由一个N端卵巢肿瘤(OTU)结构域和由七个锌指(ZF1-ZF7) 构建的 7C 端结构域组成。
1.ZnF7和ZnF4泛素结合基团介导A20的抗炎作用
虽然在动物模型中,A20的丢失会导致严重的炎症性疾病和过早死亡14,但在催化去泛素化酶(DUB)和E3泛素连接酶结构域失活突变的小鼠则发育正常,并且不会影响NF-κB的信号转导15-17。因此,在炎症性疾病的发病机制中,除了 A20 的催化活性之外,显然还有其他因素参与其中。
为了研究ZnF7泛素结合结构域在A20中的生理作用,Martens 等人在 A20 的 ZnF7结构域中做了两个失活点突变,从而产生了突变小鼠18。这些小鼠比对照型小鼠小,并出现自发性炎症病理变化,表现为脾脏肿大、关节炎症、爪肿胀、多组织免疫细胞浸润、血清细胞因子水平升高以及脾脏中髓系细胞、淋巴细胞和自然杀伤(NK)细胞数量增加。他们利用从这些小鼠体内分离的胚胎成纤维细胞,进一步证明了ZnF7结构域对于A20介导的抑制炎症信号传导和细胞死亡至关重要。
然而,在ZnF7突变小鼠身上观察到的表型并不像A20缺失小鼠那样严重。在ZnF4泛素结合域增加了两个失活点突变,小鼠的表型与完全缺失 A20 的小鼠相似,其后代严重畸形,无法存活过断奶期,并出现严重的多器官炎症和肝细胞凋亡。因此,ZnF7 和 ZnF4 这两个泛素结合域的联合失活对于炎症性疾病的发生至关重要18。他们进一步的研究揭示,ZnF7 结构域是将 A20 募集到肿瘤坏死因子受体1(TNFR1)复合物所必需的。重要的是,条件性组织特异性消减或表达突变型 A20 揭示了泛素结合在骨髓细胞和肠上皮细胞中促进炎症表型的关键作用。
2.A20非催化泛素结合能够预防类银屑病关节炎疾病
仅仅几天后,Razani等人在同一本杂志Nature Immunology上发表了文章,证实了ZnF7 和 ZnF4 结构域的重要性19。他们将ZnF7(A20ZNF7)或ZnF4(A20ZNF4)中携带半胱氨酸和丙氨酸点突变的小鼠与对照型小鼠和催化DUB结构域突变的小鼠进行了比较。至少在出生后的前四个月,ZnF4或催化结构域突变的小鼠发育正常,而ZnF7突变的小鼠从6周大开始出现渐进性指关节肿胀,到12周大时所有指关节都肿胀。此外,突变的ZnF7小鼠出现了远端指间关节的关节炎和自发性免疫激活,而其他基因型的小鼠则没有这些表型。
通过将A20ZNF7小鼠与缺乏B淋巴细胞和T淋巴细胞的Rag1-/-小鼠杂交,他们确定A20ZNF7驱动的关节炎需要淋巴细胞,因为A20ZNF7xRag1-/-发育正常。为了确定这一现象是否由B淋巴细胞、T淋巴细胞或两者共同作用,他们进一步将A20ZNF7小鼠与缺乏B细胞的μMT小鼠杂交,结果发现这些小鼠的关节炎发展与免疫能力强的A20ZNF7小鼠相似,表明A20ZNF7驱动的关节炎需要T细胞,而不是B细胞。Marten研究小组发现,在他们的模型中,骨髓细胞群中的 A20 对疾病的发病机制至关重要18。有趣的是,本研究证实了这一发现,并证明髓系分化因子MyD88信号是A20ZNF7驱动的关节炎发生所必需的19。他们的研究进一步揭示,A20的ZnF7基序是防止IKK活性延长、NF-κB依赖基因表达和关节炎发展所必需的。
与前一篇论文一样,他们随后研究了突变体ZnF7和ZnF4的组合,因为单独使用突变体ZnF7并不能再现完全缺失A20的严重程度。这一组合是协同作用的,突变ZnF7和ZnF4的小鼠会患上更严重的疾病。这两篇论文在几天内相继发表,巩固了这两个A20泛素结合结构域在预防炎症性关节炎方面的重要性。
3.A20 是治疗风湿性关节炎的潜在靶点
正如在本文中所讨论的,髓系细胞中A20泛素结合域的缺失或突变会导致小鼠出现类风湿性多发性关节炎。2021年的一项研究显示,与健康的人相比,RA患者循环单核细胞数量增加,而循环单核细胞中A20水平降低,这表明单核细胞中的A20可能对RA的发展起到保护作用20。考虑到这些发现,我国的研究人员报告了一项在小鼠身上进行的概念验证性研究,以确定通过基因疗法传递A20过表达这种保护性蛋白是否可以改善关节炎的发展。事实上,他们观察到,与接受对照载体rAAV6-CMV-EGFP的小鼠相比,接受rAAV6-CMV-A20的小鼠的临床关节炎评分、爪部厚度和孔隙率、骨体积和其他RA相关指标都有所改善21。了解A20蛋白影响疾病发病机制对于开发有效的RA治疗方法至关重要,本文中讨论的几乎同时进行的研究强调,A20的泛素结合功能而非其催化功能是防止关节炎发展的关键。
参考文献:
1.Aeschlimann FA, Batu ED, Canna SW, Go E, Gul A, Hoffmann P, et al. A20 haploinsufficiency (HA20): clinical phenotypes and disease course of patients with a newly recognised NF-kB-mediated autoinflammatory disease. Ann Rheum Dis. 2018;77(5):728-35.
2.Duncan CJA, Dinnigan E, Theobald R, Grainger A, Skelton AJ, Hussain R, et al. Early-onset autoimmune disease due to a heterozygous loss-of-function mutation in TNFAIP3 (A20). Ann Rheum Dis. 2018;77(5):783-6.
3.Kadowaki T, Ohnishi H, Kawamoto N, Hori T, Nishimura K, Kobayashi C, et al. Haploinsufficiency of A20 causes autoinflammatory and autoimmune disorders. J Allergy Clin Immunol. 2018;141(4):1485-8 e11.
4.Zhou Q, Wang H, Schwartz DM, Stoffels M, Park YH, Zhang Y, et al. Loss-of-function mutations in TNFAIP3 leading to A20 haploinsufficiency cause an early-onset autoinflammatory disease. Nat Genet. 2016;48(1):67-73.
5.Chen Y, Ye Z, Chen L, Qin T, Seidler U, Tian D, et al. Association of Clinical Phenotypes in Haploinsufficiency A20 (HA20) With Disrupted Domains of A20. Front Immunol. 2020;11:574992.
6.Odqvist L, Jevnikar Z, Riise R, Oberg L, Rhedin M, Leonard D, et al. Genetic variations in A20 DUB domain provide a genetic link to citrullination and neutrophil extracellular traps in systemic lupus erythematosus. Ann Rheum Dis. 2019;78(10):1363-70.
7.Rajamaki K, Keskitalo S, Seppanen M, Kuismin O, Vahasalo P, Trotta L, et al. Haploinsufficiency of A20 impairs protein-protein interactome and leads into caspase-8-dependent enhancement of NLRP3 inflammasome activation. RMD Open. 2018;4(2):e000740.
8.Matmati M, Jacques P, Maelfait J, Verheugen E, Kool M, Sze M, et al. A20 (TNFAIP3) deficiency in myeloid cells triggers erosive polyarthritis resembling rheumatoid arthritis. Nat Genet. 2011;43(9):908-12.
9.Wu Y, He X, Huang N, Yu J, Shao B. A20: a master regulator of arthritis. Arthritis Res Ther. 2020;22(1):220.
10.Ma A, Malynn BA. A20: linking a complex regulator of ubiquitylation to immunity and human disease. Nat Rev Immunol. 2012;12(11):774-85.
11.Onizawa M, Oshima S, Schulze-Topphoff U, Oses-Prieto JA, Lu T, Tavares R, et al. The ubiquitin-modifying enzyme A20 restricts ubiquitination of the kinase RIPK3 and protects cells from necroptosis. Nat Immunol. 2015;16(6):618-27.
12.Shams S, Martinez JM, Dawson JRD, Flores J, Gabriel M, Garcia G, et al. The Therapeutic Landscape of Rheumatoid Arthritis: Current State and Future Directions. Front Pharmacol. 2021;12:680043.
13.Polykratis A, Martens A, Eren RO, Shirasaki Y, Yamagishi M, Yamaguchi Y, et al. A20 prevents inflammasome-dependent arthritis by inhibiting macrophage necroptosis through its ZnF7 ubiquitin-binding domain. Nat Cell Biol. 2019;21(6):731-42.
14.Lee EG, Boone DL, Chai S, Libby SL, Chien M, Lodolce JP, et al. Failure to regulate TNF-induced NF-kappaB and cell death responses in A20-deficient mice. Science. 2000;289(5488):2350-4.
15.Wertz IE, Newton K, Seshasayee D, Kusam S, Lam C, Zhang J, et al. Phosphorylation and linear ubiquitin direct A20 inhibition of inflammation. Nature. 2015;528(7582):370-5.
16.De A, Dainichi T, Rathinam CV, Ghosh S. The deubiquitinase activity of A20 is dispensable for NF-kappaB signaling. EMBO Rep. 2014;15(7):775-83.
17.Lu TT, Onizawa M, Hammer GE, Turer EE, Yin Q, Damko E, et al. Dimerization and ubiquitin mediated recruitment of A20, a complex deubiquitinating enzyme. Immunity. 2013;38(5):896-905.
18.Martens A, Priem D, Hoste E, Vetters J, Rennen S, Catrysse L, et al. Two distinct ubiquitin-binding motifs in A20 mediate its anti-inflammatory and cell-protective activities. Nat Immunol. 2020;21(4):381-7.
19.Razani B, Whang MI, Kim FS, Nakamura MC, Sun X, Advincula R, et al. Non-catalytic ubiquitin binding by A20 prevents psoriatic arthritis-like disease and inflammation. Nat Immunol. 2020;21(4):422-33.
20.Zhang L, Yao Y, Tian J, Jiang W, Zhou S, Chen J, et al. Alterations and abnormal expression of A20 in peripheral monocyte subtypes in patients with rheumatoid arthritis. Clin Rheumatol. 2021;40(1):341-8.
21.Zhang Q, Yu FX, Wu YL, Yang CY, Liu NC, Zhu X, et al. Novel gene therapy for rheumatoid arthritis with single local injection: adeno-associated virus-mediated delivery of A20/TNFAIP3. Mil Med Res. 2022;9(1):34.





