以阿霉素为模型药物利用nFCM在单颗粒水平对六种药物装载策略对比

厦门大学颜晓梅教授团队在Analytical and Bioanalytical Chemistry上发表题为“Single‑particle assessment of six different drug‑loading strategies for incorporating doxorubicin into small extracellular vesicles”的文章,以阿霉素(Doxorubicin, Dox)为模型药物,利用nFCM(纳米流式)在单颗粒水平对六种药物装载策略(共孵育、电穿孔、挤出法、反复冻融、超声和表面活性剂处理)进行对比,综合评估几种方法对sEVs药物包封率、药物装载量、表面蛋白功能维持、长期保存稳定性等影响,为基于sEVs的药物装载和递送研究提供了一个快速、灵敏的单颗粒分析方法。
图1. nFCM评估EVs药物装载策略
EVs质量控制
选用HEK293T来源的EVs装载Dox作为标准模型,研究六种药物装载策略对装载Dox药物的效果。经过超速离心的方法从293T细胞上清中分离得到纯化的EVs,首先对EVs粒径、形态、纯度、蛋白等进行表征,评估获取的EVs的质量。利用Triton X-100处理的方法评估EVs的纯度,nFCM结果显示在经Triton X-100处理后,EVs颗粒数明显下降,EVs的纯度高达80%;粒径结果也显示EVs粒径均在220 nm以下,峰值为52 nm,中位值为103 nm,符合MISEV2018中建议的EVs粒径分布范围(图2)。
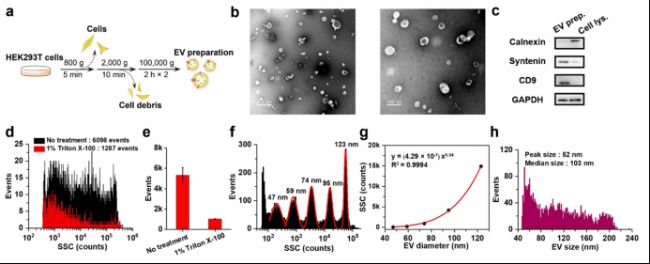
图2. EVs的鉴定和表征
载药策略对比
由于Dox具有自发荧光特性,与未装载Dox的EVs相比,装载了Dox的EVs表现出明显的橙色荧光信号,阳性颗粒的比例可达46.3%;在共孵育方法中,随着Dox浓度的增加,阳性EVs的比例持续上升,当Dox浓度为100 μM时,EVs的阳性率达到最高,接近50%(图3);
以优化后的Dox浓度(100 μM)为参考,评估对比了共孵育、电穿孔、挤出法、反复冻融、超声和表面活性剂处理这六种方法对EVs载药效率、颗粒浓度、药物装载量等影响。结果显示共孵育和电穿孔法具有最高的装载效率,均为40%以上,而其他几种药物装载策略阳性率在20%-30%之间(图3)。总的来说,考虑到药物包封率、颗粒浓度、药物装载量等因素,共孵育和电穿孔是这几种方法中最理想的EVs药物装载策略。
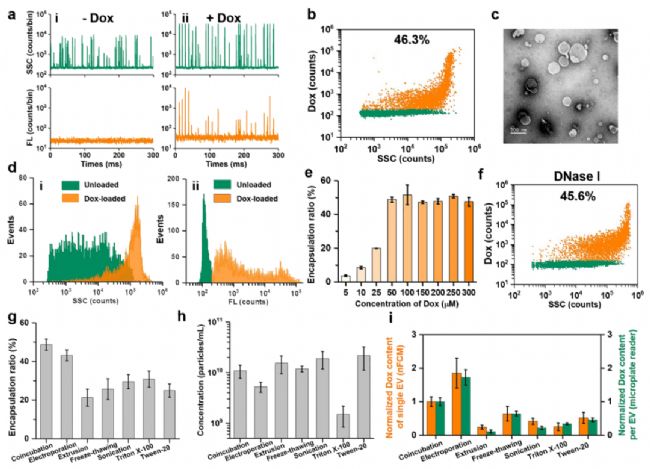
图3. 不同药物装载策略的载药效率、药物装载量对比
生物功能分析
EVs表面蛋白是其功能形式的重要参与者,对EVs的免疫逃逸和靶向具有重要作用,作者进一步研究了不同药物装载策略对EVs表面蛋白的影响。结果发现,共孵育和电穿孔方法处理后EVs的表面蛋白(CD24、CD47、CD63)表达比例相对更高,说明这两种方法能够最大限度地保持了EVs的生物活性,而挤出法、反复冻融、超声和表面活性剂处理都会不同程度地破坏EVs的表面蛋白(图4)。
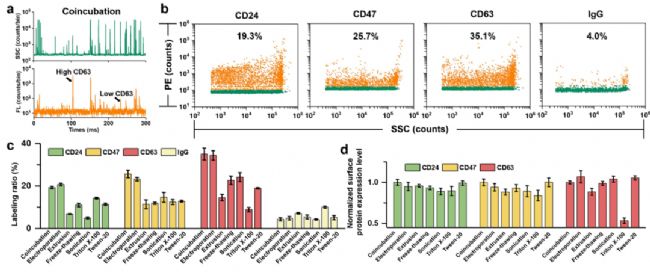
图4. 不同载药策略对EVs表面蛋白的影响
作者进一步评估了不同策略所得载药EVs中药物稳定性和活性(图5)。结果显示在4℃和-80℃条件下保存,随着时间的延长,六种装载策略获得的EVs阳性率均出现下降,而共孵育方法获得的EVs在长期保存下还能保持较高的药物包裹效率(约40%)。综上,无论何种载药方式,都建议将装载Dox的EVs储存在4℃,且共孵育制备的Dox-EVs显示出最高的包封率和稳定性。
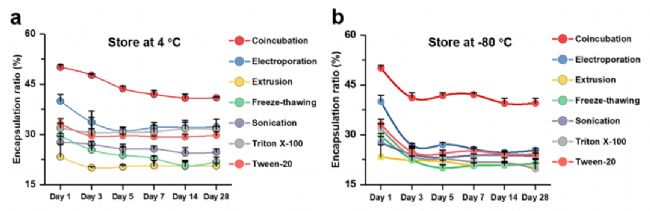
图5. 载药后EVs的稳定性研究
药物作用效果
作者还探究了不同药物装载策略所得Dox-EVs的药物活性和细胞摄取效率。共聚焦显微镜和流式细胞术的结果均证实电穿孔的方法获得的EVs具有更高的细胞摄取效率,同时更容易诱导细胞凋亡(图6)。该结果与nFCM测定的不同方法药物包封效率和药物包裹量相吻合,说明了Dox-EVs的治疗效果与细胞摄取率密切相关,并从本质上与Dox的包封率有关,揭示了利用nFCM对EVs进行单颗粒载药表征的准确性和重要价值。
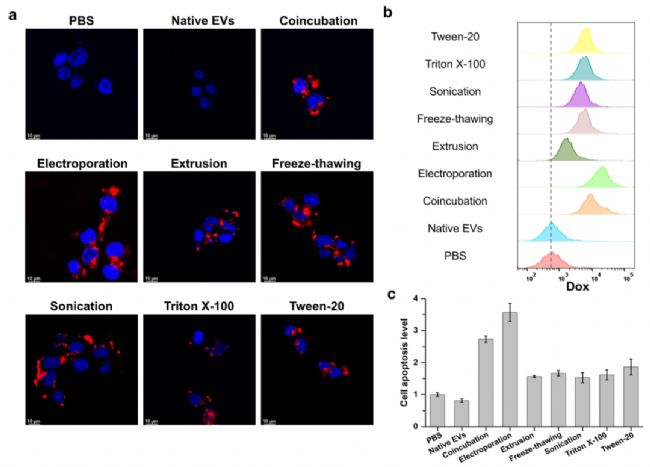
图6. 不同载药策略的药物活性
总结
本研究利用nFCM在单EV水平对六种不同的载药策略进行了全面的评估。实验结果表明:
-
共孵育和电穿孔方法可以获得更高的装载效率,单个EVs中Dox含量也最高;
-
共孵育和电穿孔方法制备的EVs药物具有更高水平的细胞摄取和更显著的促进肿瘤细胞凋亡;
-
共孵育方法获得的EVs无论在4℃或-80℃长期保存条件下,均具有更好的稳定性;
nFCM作为一个高效的单颗粒表征平台,可应用于EVs研究的各个环节,包括分离纯化、质量控制、EVs载药方法评估和优化、稳定性监测等方面,加速推进EVs产业化的发展!
参考文献
Chen, C., Li, Y., Wang, Q. et al. Single-particle assessment of six different drug-loading strategies for incorporating doxorubicin into small extracellular vesicles. Anal Bioanal Chem 415, 1287–1298 (2023). https://doi.org/10.1007/s00216-022-04248-4





