Blood Cancer Discov封面文章:外泌体研究的创新如何突破常规?
过往的很多研究基于体外培养细胞来源的外泌体开展功能研究,这就在一定程度上有别于体内真实微环境中的外泌体,因此直接研究组织来源的外泌体在这一点上就体现出了很大的优势。今年1月份新晋期刊Blood Cancer Discov杂志发表了一项研究肿瘤微环境来源的外泌体功能的文章[1]。该文研究了慢性淋巴细胞白血病(CLL)脾脏组织来源的外泌体影响CD8+T细胞的功能,减弱CD8+T细胞对CLL细胞的杀伤能力,从而促进CLL进展。值得一提的是该研究利用组学技术一步步挖掘外泌体的功能机制,其分析思路非常值得大家借鉴。

1.外泌体合成和分泌与CLL具有显著相关性
研究人员通过分析外泌体合成和分泌途径中相关分子的表达,试图找到CLL和外泌体间的联系。首先通过检索GEO数据库发现了CLL病人的B细胞中外泌体合成相关基因的表达要显著高于健康人(图1左),并且某些基因如Rab35、Rab40c在预后差的病人(IGHVUM)中显著高于那些预后好的病人(IGHVM)(图1左),这说明了CLL与更多的外泌体合成和分泌具有相关性。之后研究者纳入了144例CLL患者,通过RT-qPCR检测了7个外泌体合成和分泌相关基因的表达,鉴别了Rab27a和RAB31与预后不良显著相关,高表达两个基因的患者的OS显著降低(图1右)。这些结果说明了外泌体与CLL存在密切的关系,在CLL发生和进展中外泌体发挥着重要作用。
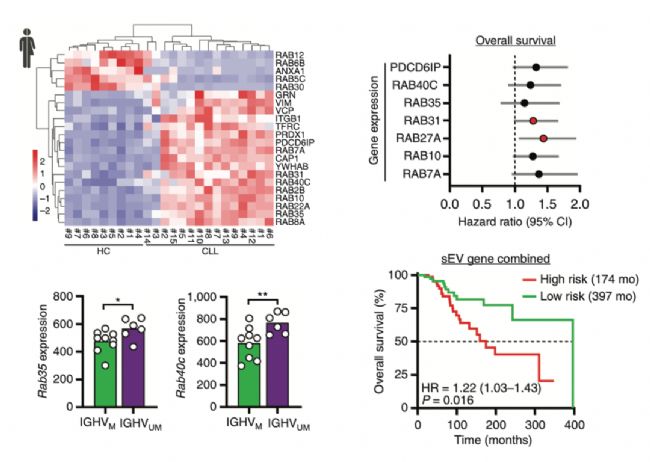
图 1. 分析CLL和外泌体合成间的相关性
2.CLL组织微环境中含有更多的外泌体
首先研究人员提取了CLL小鼠和正常小鼠脾脏组织中的外泌体,分别定义为白血病微环境外泌体(LME-sEVs)和健康对照微环境外泌体(HCME-sEVs)。蛋白定量和粒子浓度检测表明了CLL组织微环境中含有更多的外泌体(图2),这与上述中外泌体合成基因在CLL中高表达呈现了很好的一致性。这些结果说明肿瘤微环境中外泌体的合成或分泌会被显著激活。
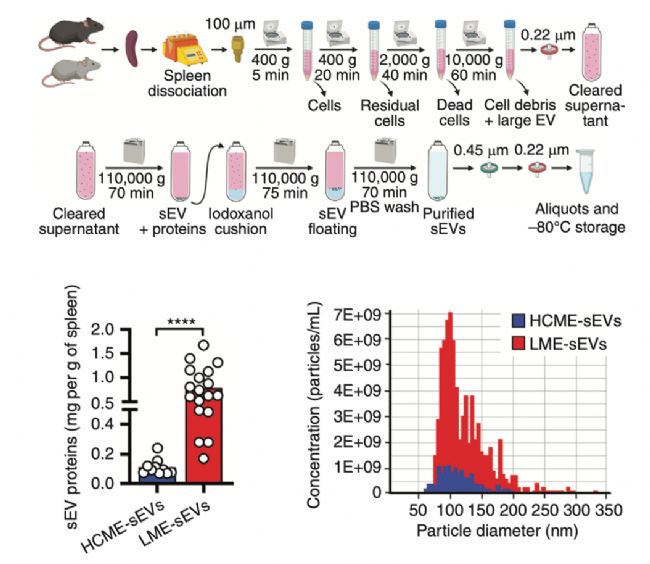
图2. 提取和分析脾脏来源的外泌体
3.CLL外泌体高表达免疫检查点配体和肿瘤相关miRNA
首先研究人员开展了外泌体label free蛋白组学分析,结果发现很多差异蛋白与免疫过程相关,尤其是参与淋巴细胞激活、迁移和细胞因子产生等,这说明LME-sEVs可以参与微环境中免疫调节过程。引起研究人员注意的是几个免疫检查点配体(LGALS1、LGALS9和IL4I1)高表达在LME-sEVs中,这说明LME-sEVs或许可以抑制表达相应受体的免疫细胞活性。研究人员又通过成像流式和单囊泡流式验证了重要的免疫检查点配体如PD-L1和GAL9可以共表达在LME-sEVs中(图3上)。除了这些关键的蛋白,研究人员又检测了几个已发现的在CLL等癌症中高表达的miRNA同样的也高表达在LME-sEVs中(图3下)。以上这些结果说明了CLL外泌体富含参与肿瘤免疫的蛋白和miRNA,通过这些分子可以参与免疫调控。
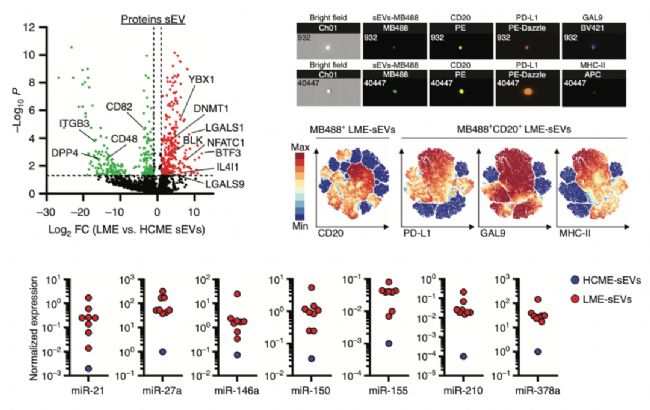
图3. 外泌体蛋白组学和miRNA检测
4.CLL
研究人员首先通过体外和体内示踪实验发现了荧光标记的LME-sEVs可以被脾脏组织中的CD4+Tconv细胞、Treg细胞和CD8+T细胞摄取(图4左)。然而相比HCME-sEVs 处理的细胞,LME-sEVs唯一能改变的是CD8+T细胞的转录组和蛋白组表达谱,这说明LME-sEVs主要作用于CD8+T细胞。蛋白组学分析发现了LME-sEVs处理后CD8+T细胞的效应蛋白显著下调,并且很多与代谢相关的蛋白也发生了显著性的变化(图4左)。体外代谢指标检测发现了LME-sEVs处理可以增加CD8+T细胞的葡萄糖消耗,减少氧消耗(图4右),增加糖酵解过程,而糖酵解的增加可以抑制CD8+T细胞的活性,这说明LME-sEVs可以影响CD8+T细胞的代谢从而抑制CD8+T细胞活性。之后研究人员分析了CD8+T细胞的表型和功能,结果发现了LME-sEVs可以增加CD8+T细胞表达免疫检查点受体,呈现活性抑制性表型,并且可以减弱CD8+T细胞对CLL细胞的毒性作用(图4右)。
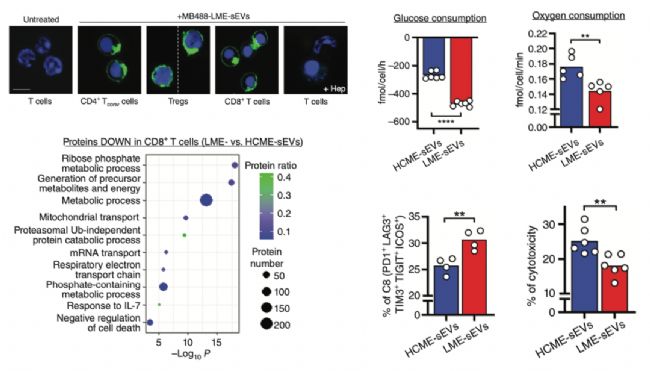
图4. LME-sEVs改变CD8+T细胞蛋白组、代谢、表型和功能
5.CLL外泌体通过免疫检查点配体和miRNA共同行使功能
研究人员检测了LME-sEVs可以通过传递3个重要miRNA到CD8+T细胞中发挥作用(图5上)。预先在CD8+T细胞中转染这些miRNA的拮抗剂后,LME-sEVs抑制CD8+T细胞活性的效果得到拯救(图5上)。并且LME-sEVs被4个免疫检查点配体(PD-L1, GAL9, VISTA, MHC-II)的抗体预先中和后,也会失去抑制CD8+T细胞活性的作用(图5下)。这些结果说明了LME-sEVs通过多种功能分子对CD8+T细胞发挥多效的作用,从而抑制其活性。
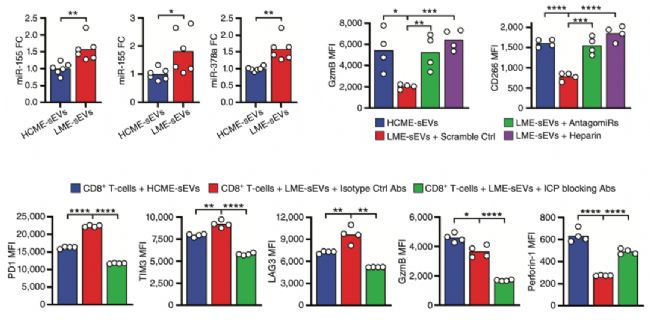
图5. LME-sEVs通过蛋白和miRNA调控CD8+T细胞活性
6.CLL外泌体通过抑制CD8+T细胞活性促进CLL进展
研究人员首先获得了外泌体合成分子Rab27a/Rab27b突变的CLL小鼠模型,发现了外泌体合成受阻后,外周血中CLL细胞显著减少(图6左);
其次在正常小鼠中注射来源于Rab27a/Rab27b突变的CLL小鼠的肿瘤细胞,这些肿瘤细胞不会生长。但是同时注射LME-sEVs后,接种的CLL细胞恢复生长(图6中);
最后在丧失CD8+T细胞活性小鼠中同时接种Rab27a/Rab27b突变的CLL小鼠的肿瘤细胞和LME-sEVs处理的CD8+T细胞或者HCME-sEVs处理的CD8+T细胞,结果发现了LME-sEVs处理的CD8+T细胞可以显著增加外周血中CLL细胞的数量(图6右)。
以上体内实验说明了肿瘤微环境中的外泌体通过抑制CD8+T细胞活性,减弱CD8+T细胞对CLL细胞的杀伤能力,从而增加体内CLL细胞的数量,促进疾病恶化。
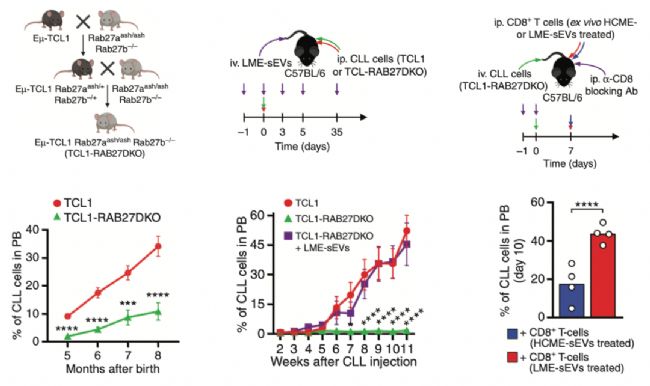
图6. 体内实验验证LME-sEVs的功能
总结与讨论
随着外泌体的研究越来越多,研究深度越来越深,既往外泌体常规的研究范式也会受到很大的挑战,除了新颖性,更重要的是找到外泌体与临床相关性的突破口。本项研究从最源头的外泌体合成和分泌入手,找到了这一过程与临床现象密切相关,随机开展外泌体的机制研究。而机制研究也是摒弃了大量的细胞系实验,聚焦利用组织来源外泌体,利用原代细胞和动物模型开展功能研究,更加贴近真实场景。利用转录组和蛋白组等多组学手段分析外泌体及作用的细胞,无偏倚的研究让结果分析更加全面和准确。最后本文也提醒我们外泌体或许不只仅靠某一类分子发挥功能,而是依赖于多种分子共同执行特定的作用,所以需要同步考虑外泌体的蛋白、miRNA等其他分子。
# 关于华盈 #
上海华盈生物医药科技有限公司(以下简称“华盈生物”)成立于2012年,是外泌体研究服务领域的领导品牌,拥有外泌体研究“一站式服务”体系,覆盖外泌体研究的方方面面,包括:外泌体的三项鉴定(电镜、WB、NTA)、外泌体蛋白组筛选(Labelᅠfree、DIA、PRM、MRM)、外泌体核酸筛选(miRNA、全转录组)、外泌体纳米流式检测、外泌体细胞&动物功能实验(PKH26/DiR/量子点、荧光示踪)等。多年来华盈生物服务客户已经覆盖国内各大著名的高校院所和多位院士课题组。华盈的专业和专注也已获得业界普遍认可,华盈生物外泌体研究合作伙伴的科研成果也先后在AdvᅠSci、JᅠClin Invest、Biomaterials、Cancer Res等著名期刊上发表。
相关文献
Gargiulo E, Viry E, Morande PE, Largeot A, Gonder S, Xian F et al. Extracellular Vesicle Secretion by Leukemia Cells In Vivo Promotes CLL Progression by Hampering Antitumor T-cell Responses. Blood Cancer Discov. 2023;4(1):54-77.





