高分子纳微球在工程疫苗中的新应用(下)
在文章《高分子纳微球在工程疫苗中的新应用(上)》中提到了基于高分子纳微球发展新型给药系统成为生物医药领域研究和关注的焦点,并阐述了纳微球均一性的重要性以及均一纳微球制备新过程-预分散-快速膜乳化法制备技术(点击标题可查看全文)。
接下来小编给大家分享后续科学成就以及展望。
3 均一纳微球作为工程疫苗底盘的设计和制备
蛋白/多肽等新型亚单位抗原,离开病原体骨架和成分的支撑和辅佐,其免疫原性和稳定性显著下降,必须添加佐剂来增强疫苗免疫应答. 目前最广泛使用的铝盐佐剂对很多亚单位疫苗的效果有限,且无法诱导治疗性疫苗所需的细胞免疫应答. 基于上述发展成熟的纳微球制备方法,构建均一纳微颗粒作为底盘,与亚单位抗原共组装为工程化疫苗后,可利用底盘骨架提高亚单位抗原的稳定性,利用材料成分提高疫苗的免疫应答.主要开展的相关工作涉及普通物化性质的颗粒底盘、具有溶酶体逃逸功能的底盘、具备特殊性质的(二维变形性和柔性)底盘以及具有体液/黏膜免疫双响应优势的底盘等.
3.1 不同物化性质纳微球对免疫效果的影响
自然界中的颗粒性质直接决定纳微球的生物学行为[32]. 在充分了解纳微球的物理化学性质(粒径大小、微观形貌等)对生物学效应,尤其是抗原提呈细胞APC(如巨噬细胞和树突状细胞)的影响之后,可以设计颗粒性质以获得期望的疫苗免疫效果[33~35]. 特别地,如果颗粒尺寸均一,可确保在单一变量的情况下,更清晰地阐明特定物化性质与细胞/免疫应答之间的构效规律.借助前面提到的均一纳微颗粒制备方法,并结合分子修饰、改性或镀层手段调控底盘物化性质,我们相继制备出不同尺寸、电荷以及形状的颗粒,并考察其初步生物学、免疫学效应(图3).在粒径方面,纳米及亚微米级颗粒(如430 nm)较微米颗粒(≥ 1 μm)易被抗原提呈细胞(APC,如巨噬细胞)摄取,负载抗原后能够有效延长抗原停留时间,并展示出更强的APC活化效果[15,36,37]. 除细胞内吞外,Manolovae等发现纳米级颗粒(20 nm)还引发了更强烈的淋巴结靶向效应[38]. 在电荷方面,APC对正电颗粒(P-NP)的摄取量远高于中性(M-NP)和负电颗粒(N-NP),并能显著促进颗粒从溶酶体的逃逸,具有增强细胞免疫应答的潜力[25].即使在生理pH为中性,在胞内溶酶体(~ pH 5.5)中呈正点性的羧化壳聚糖纳米球[39]或两性脂质体[40],也可以利用电荷翻转的优势将抗原释放到胞浆中,引发细胞免疫. 在形貌方面,杆状颗粒被APC的摄取量显著高于链状、Y型分支状和球型颗粒[41],通过表面配基(甘露糖)与APC(如树突状DC细胞)的识别可进一步提高摄取效率. Niikura等也证明了杆状颗粒具有更快的内吞速率[42]. 这种优势主要与颗粒接触细胞膜时的角度(Ω)有关,棒状颗粒的Ω更小,内吞更快. 基于以上机制和规律的揭示,我们将特定物理或者化学性质的微球,纳入不同疫苗中,考察了相关预防和治疗效果. 例如,将正电改性修饰的PLA亚微米级颗粒底盘与乙肝表面抗原共组装[26,43],抗体水平和干扰素水平分别较现有佐剂提高了1倍和14倍,转阴率达到50%. 而且所制备的高分子纳微球可以冻干,无需冷链运输,避免了商品化铝佐剂的该项难题,为发展具有治疗性效果的乙肝疫苗奠定了基础. 除此之外,通过将甘露糖化的杆状颗粒底盘与肿瘤抗原共组装,用于肿瘤的免疫治疗,不仅可以达到抑制肿瘤生长的目的,还可以有效防止肿瘤转移.如上所述,通过使用特定物化性质的均一颗粒,可以发现纳微颗粒增强免疫效果的多重作用和增强细胞免疫效果的关键途径. 首先,相比游离抗原,组装在颗粒上的抗原可显著降低其在注射部位的流失. 其次,携带抗原的颗粒可通过模仿病原体的尺寸被免疫细胞有效识别和摄取. 再次,内吞的颗粒和降解的成分可增强APC活化能力. 最后,颗粒可以改变抗原在APC内的转运加工途径(溶酶体中→细胞质中).
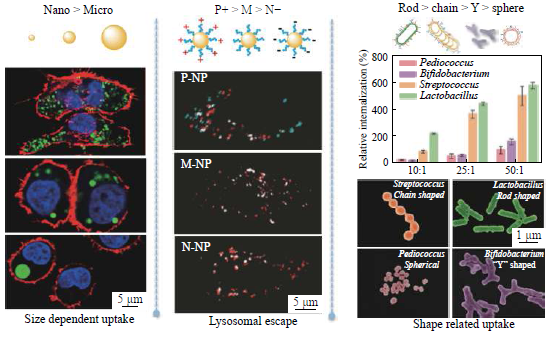
Fig. 3 The effect of particleproperty on the cellular responses (Left panel was reprinted with permissionfrom Ref.[15],Copyright (2010)Elsevier; Middle panel was reprinted with permission from Ref.[25], Copyright (2011)American Chemical Society; Right panel was reprinted with permission from Ref.[41], Copyright (2017)WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim)
3.2 溶酶体逃逸颗粒底盘的制备和应用
利用正电荷、纳米尺寸等常规颗粒底盘开展的研究工作很好地揭示了外源性抗原从溶酶体逃逸至胞质中,是治疗性疫苗或肿瘤疫苗发挥作用的关键,为疫苗开发提供了思路. 这主要是因为抗原在胞质中将循MHCI分子途径提呈(即“交叉提呈”),激活杀伤性T细胞,获得细胞免疫应答.针对溶酶体内的低pH微环境,我们进一步设计了壳聚糖、聚乳酸类(PLGA)、碳酸钙等颗粒底盘,使其充分利用溶酶体酸性环境,发生溶胀、产气等效应,促进抗原逃逸,更大幅度提升了细胞免疫效果(图4).

Fig. 4 The scheme of threedifferent particulate chassis with lysosomal escape merit:(a) Chitosan gel MPchassis(Reprinted with permission from Ref.[44]; Copyright (2014)WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim), (b)PLA hollow chassis(Reprinted with permission from Ref.[45], Copyright (2015) American ChemicalSociety), (c) CaCO3crystal NP chassis (Reprinted with permission from Ref.[46];Copyright (2018) WILEY-VCH Verlag GmbH & Co. KGaA,Weinheim)
3.2.1 壳聚糖凝胶纳米颗粒底盘
基于季铵化壳聚糖/甘油磷酸盐或/聚乙二醇三元组分在升温过程中分子间氢键作用的变化,使壳聚糖链与物理交联剂发生原位凝胶化反应,然后将该温敏体系和膜乳化技术相结合,室温下得到均一液滴,升温后自固化成凝胶颗粒[44]. 该颗粒(Gel MP) pH敏感性远优于化学交联的壳聚糖颗粒,可迅速溶胀溶酶体使之破裂,促使大量抗原逃逸. 动物水平上,将H5N1裂解抗原负载于上述凝胶纳米颗粒底盘,其血清IgG抗体水平和细胞免疫指标(如干扰素IFN-γ)均可达到商品化铝佐剂的3倍.
3.2.2 PLGA中空纳米颗粒底盘
PLGA是安全性好的可注射用高分子材料,但本身不具有pH敏感性和智能性. 通过借助复乳演变过程,可将碳酸氢铵和抗原共同装载在到PLGA中空纳米颗粒底盘内(Hollow MP)[45]. 该颗粒底盘进入细胞后,碳酸氢铵在酸性溶酶体内变成气体,冲破微囊,引起溶酶体破裂,促使大量抗原逃逸到细胞质. 与普通PLGA颗粒底盘(Solid)相比,Hollow底盘诱导的IgG抗体水平相比于铝佐剂提高了3.9倍,细胞免疫指标(如干扰素IFN-γ)提高了2.8倍.
3.2.3 CaCO3自组装纳米颗粒底盘
基于前期研究发现CaCO3纳米颗粒的形成机理[14],我们进一步提出以肿瘤抗原为模板诱导
CaCO3结晶,制得抗原与球文石纳米晶的共组装纳米颗粒[46]. 球文石纳米晶在溶酶体酸性条件下溶解快速产生CO2,以此破裂溶酶体并诱导胞内自噬,显著提升了特异性MHCI分子的表达水平,增强了细胞免疫应答效果. 注射该肿瘤疫苗,小鼠肿瘤生长速率降低了9倍,生存时间也得到有效延长.
3.3 二维颗粒底盘
开发与传统颗粒形状甚至维度不同的纳微颗粒制剂是一个新兴方向[47]. 陈春英、刘庄等研究者分别探索了零维富勒烯[48]、一维碳纳米管[49]以及二维石墨烯[50]在药物递送和诊断方面中的潜力.以疫苗免疫为出发点,我们利用粒径均一的氧化石墨烯及其衍生物,揭示了独特的维度效应和全新的纳米-细胞界面效应(图5). 首先,二维颗粒和三维颗粒与细胞的相互作用完全不同. 二维颗粒选择性地被吞噬类细胞摄取,吞噬量和比表面积成正比,与粒径无关. 与三维颗粒呈相反的规律,微米级二维颗粒被免疫细胞吞噬后,对免疫细胞的活化强于纳米级[51]. 这主要是由于微米级二维颗粒在胞内受到空间位阻及限域作用,发生折叠变形,并诱导细胞内自噬,协同强化免疫细胞应激反应. 其次,通过对二维颗粒表面修饰和免疫效应的构效关系研究,进一步发现了免疫细胞活化新现象和新机制:聚乙二醇修饰的二维颗粒不会被免疫细胞吞噬,但会在细胞表面与磷脂双分子层产生动态相互作用,以此激活整合素介导的全新力学信号,实现对免疫细胞的高效活化[52,53].再次,团队发现了二维粒子-生物膜三明治超级结构存在和形成的实验证据,并揭示了该结构对细胞粗糙度、细胞流动性和细胞膜硬度的影响[54].特别地,二维粒子可借助该结构使更多膜特异性药物和受体进入细胞膜间,实现活性物质在膜磷脂双分子层的快速运动和扩散,可以更有效与膜上靶点相互作用,远优于脂质体的全胞内扩散和递送效果.基于二维颗粒(如氧化石墨烯GO)的多种优势,我们提出将其作为肿瘤预防性和治疗性抗原的底盘,其高比表面积及ΠΠ共轭结构可将抗原装载量提升至500%,并通过GO的折叠、自噬等效应,有效保护抗原,延长抗原作用时间,促进APC募集以及MHCI抗原交叉提呈活化,引发细胞应答[55]. 用于肿瘤模型动物的免疫治疗后,肿瘤生长得到显著抑制,体积比对照组降低80%.上述二维颗粒底盘工作发展了针对疫苗组分的精准高效递送模式,为生物医药全新剂型的设计和纳米粒子的应用提供了方向.

Fig. 5 The unique properties ofthe 2D vaccine chassis for potent tumor vaccine: (a) 2D graphene oxide (GO)exhibiting a size-independent uptake event and selective internalization inphagocytes; (b) GO in micro size prefering to be fold in cells (left panel) andinduces active cell recruitment (right panel) (a and b were reprinted withpermission from Ref.[51], Copyright (2012) Elsevier); (c) High levelsof cytokine secretion (upper left panel), membrane interaction (lower left panel),and the proposed signal activation pathways (right panel) upon the introductionof PEGylated GO (Reprinted with permission from Ref.[53]. Copyright (2017) NaturePublishing Group); (d) The scheme and corresponding evidences for the sandwichedgraphene-based membrane superstructure (Reprinted with permission from Ref.[54], Copyright (2019) AAAS);(e) Efficient tumor inhibition after GO-OVA vaccination (Reprinted withpermission from Ref.[55]; Copyright (2015) The Royal Society of Chemistry)。
3.4 动态柔性Pickering乳液底盘
病原体和免疫细胞接触时具有变形性,接触区域从点增加为面,同时其表面图案分子具有流动性,有利于迅速和免疫细胞形成多价相互作用[56,57],加速免疫细胞的识别、吞噬速度和吞噬量. 受此启发,团队提出一种底盘可变形、抗原可流动的仿生工程疫苗构建新思路:用生物可降解的PLGA纳米颗粒替代表面活性剂稳定角鲨烯油滴,以Pickering乳液为底盘,将抗原组装在纳米颗粒之间,构建成可变形工程化疫苗[58]. 该底盘中,Pickering乳液具有柔性和粘弹性,可以使抗原在细胞膜表面沉积,并产生应力形变,增大免疫识别面积. 而且组装在纳米颗粒之间的抗原具有流动性,再现了病原体与免疫细胞的三维动态识别,具有很好的预防和治疗效果.该Pickering底盘突破以往疫苗佐剂的设计思想,主要包含以下3种仿生特征(图6):(1)凹凸的高比表面积使抗原的装载量远高于一般纳米或微米颗粒,同时颗粒间的限域空间提高了抗原的稳定性;(2)表面具有变形性、流动性和密集图案化,再现了病原体与免疫细胞的三维动态识别,大幅度增加与免疫细胞的接触面积和多价相互作用,促进免疫细胞的捕获;(3) PLGA高分子纳米颗粒在酸性溶酶体中发生电荷反转(材料表面羧基发生质子化呈现正电荷,导致溶酶体内膜不稳定),诱导抗原逃逸到细胞质中,显著增强细胞免疫.基于以上优势,该底盘上组装H1N1重组亚单位疫苗后,得到了最高的攻毒保护率,攻毒实验中没有动物死亡,安全性和保护性远优于MF59等其他现有市售佐剂. 与黑色素瘤多肽组装后,可以有效调动脾细胞中干扰素分泌T细胞的活化和增殖,肿瘤的治疗效果优于AS04等现有佐剂.

Fig. 6 The mechanism and highefficiency of Pickering emulsion chassis in tumor vaccine: (a, b) Schematicillustration (a) and corresponding evidences (b) for the advantageous Pickeringemulsion chassis. The merits includes ① high efficient construction, ② increased cell-chassiscontact area and multiple recognition, and ③ charge reversal related lysosomal escape. (c)Potent adjuvanticity for H1N1 (upper) and MUC1 anti-tumor (lower) vaccination(Reprinted with permission from Ref.[53], Copyright (2017) Nature Publishing Group)
3.5 免疫车票(硬乳液底盘)
常规的肌肉注射或皮下注射难以诱导远端的黏膜免疫响应[59]. 通过采用内向乳液颗粒化技术,我们对疫苗底盘进行刚性改造,构建了高分子颗粒/乳液复合型硬乳液,可实现抗原和免疫细胞肠粘膜归巢信号物质(如全反式维甲酸RA)的协同装载和时空有序释放. 这种硬乳液颗粒在肌肉注射之后,可以像“免疫车票”(Immunoticket)一样诱导外周树突细胞(DC)产生趋化因子(CCR9),并“搭乘上”外周淋巴系统到肠黏膜相关淋巴组织的“高速列车”—趋化因子CCL25浓度梯度,迁移至肠道相关淋巴组织(GALTs),从而引发系统性免疫和粘膜免疫双响应[60](图7).RA是一种疏水性小分子,虽然具有诱导肠黏膜免疫的潜力,但以往对RA的使用策略,不仅生物利用度低,需要反复给药,并且还会引起免疫抑制、生物毒性等副作用,大大降低了其佐剂效应[61]. 在免疫车票策略中,通过对高分子相演变过程的调控,制备具有柔性内核(角鲨烯乳滴)和刚性外壳(高分子/阳离子脂质体)的硬乳液纳米球,可将油溶性RA包埋在内部油相中,抗原可吸附在带正电荷的颗粒表面. 进一步借助底盘颗粒表面的正电荷,诱导颗粒的溶酶体逃逸. 逃逸到细胞质中的硬乳液颗粒发挥长效持久缓释RA的能力,引发DC产生肠黏膜归巢受体,并促使抗原经细胞质途径被交叉提呈至MHC I,实现了抗原和RA的联合递送. 基于以上优势,该硬乳液底盘可有效诱导模式抗原OVA负载的树突状细胞从引流淋巴结定向迁移至肠道部位,实现通过注射免疫途径同时增强肠道黏膜、体液及细胞三方面免疫应答.此外,硬乳液颗粒Immunoticket还具有良好的“底盘”效应(免疫普适性). 以手足口病疫苗EV71 (一种肠黏膜传染病)作为抗原的研究表明,Immunoticket能够引发强烈的细胞特异性免疫应答,并同时促进EV71特异性黏膜抗体IgA以及系统性IgG抗体的分泌,有望改变现有疫苗佐剂对于经胃肠道感染疾病预防效果不佳的现状. 因此,Immuoticket通过控制活性物质和抗原的有序释放,展现了纳微颗粒底盘作为系统性免疫和粘膜免疫双响应佐剂的应用前景,为拓展免疫应答的广度和深度提供了新思路.

Fig. 7 Solid emulsion chassis actas“immunoticket”and induces simultaneoussystemic and gastrointestinal immune activations: (a) Schematic illustration onimmunoticket strategy. (The immunoticket chassis cultivated the peripheral lymphocytes with gut homingreceptors, which served as the “tickets”to hitchhike on the “express train” of CCL25 concentrationgradient to the GALTs); (b) Schematic illustrations on the internal phaseseparation process to prepare immunoticket chassis; (c) Population of gut-infiltratedCTL (SIINFEKL-MHC I+ CCR9+ CD8+); (d) Anti-OVA IgA titers in the supernatant ofintestinal trituration fluids (Reprinted with permission from Ref.[60], Copyright(2018) WILEY-VCH Verlag GmbH & Co.KGaA, Weinheim)
4 总结论与展望
针对现有疫苗递送体系免疫活化效果差、适应性范围窄、缺乏工程化平台效应且免疫机制匮乏等问题,我们提出疫苗构建的中心法则“疫苗 =免疫原 + 递送系统 +佐剂”,即以纳微颗粒构建疫苗“底盘”,按需整合免疫原和佐剂等“部件”,为现有疫苗提供合成化和生物化递送平台.上述平台构建依赖于团队发展成熟的预分散-快速膜乳化技术、高分子乳液聚合等手段,不仅实现了颗粒从0.1 ~ 30 μm的粒径均一可控,而且制备出了不同物化性质的高分子纳微球常规底盘,用于免疫学效应构效关系和作用规律的阐明. 在此基础上,通过对底盘尺寸、电荷、成分、形状、柔性等进行合理化设计,进一步构建了溶酶体逃逸颗粒底盘、可变形二维颗粒底盘、动态Pickering底盘以及免疫车票等,全面提升了天然免疫的活化以及预防性免疫和治疗性免疫的应答水平,为底盘和先进疫苗的设计和应用奠定了基础.当前研究为智能型颗粒底盘的设计搭建了良好的研究平台,但是如何通过更巧妙的设计将免疫原、佐剂和底盘按需组装、有机整合,是下一步继续努力的方向. 特别地,疫苗底盘策略需重点关注以下两个方面:(1)底盘应该仿生,各“部件”分子需要装在特定的地方. 除模拟病原体(肿瘤细胞、细菌、病毒等)的尺寸、电荷、形状和成分,重现病原体流动性、变形性是非常具有前景的仿生方式. 在此基础上,将特定佐剂(如受体激动剂和细胞因子)按照其作用位点(细胞膜或胞内细胞器)和功能(免疫识别或激活),装载于具有流动性(如Pickering颗粒)或变形性(二维粒子)的底盘,并按需设计二者位于高分子合成颗粒底盘的空间位置(表面或空腔),所构建的动态流动性调控平台将更为仿生. 利用该平台可寻找配基流动性与靶细胞受体动态化富集响应的潜在关系,进而构建高效激活天然免疫应答和适应性免疫响应的疫苗体系. (2)通过底盘实现免疫原佐剂相对暴露速度和程度的调控. 由于不同的装载位置决定了免疫的识别次序和应答效果,增加免疫原/佐剂的装载率、改变装载位置,调节活性成分递送的时空耦合性是一种重要措施,可借助多个底盘和物化性质(电荷、尺寸及形状)的“拼搭”,构建高效装载免疫原和佐剂的多级降解结构底盘. 例如,该多级底盘内部为乳液,外部为颗粒/壳层(如聚乳酸等有机高分子颗粒、碳酸钙/铝等无机纳米粒子、二维石墨烯、杆状纳米颗粒、生物囊泡等),将免疫原和佐剂分别装载于乳液内核、颗粒(表面或内部)或以吸附或疏水嵌插的方式装载于油/水界面的颗粒间的缝隙中. 借助疫苗底盘在体内和细胞内部(如溶酶体、细胞质)环境中的暴露、内化和降解代谢程序,实现抗原、活性物质的逐级/选择性释放、增敏以及起效,满足新型疫苗时空耦合响应的需求.综上,疫苗底盘策略发展潜力巨大. 一方面,可针对当前重大疾病的防御和治疗需求(如新传染病疫苗、多价疫苗、精准肿瘤疫苗以及免疫原库等),对疫苗的组装和递送进行工程化整合及合理化设计,最大化疫苗递送效果. 另一方面,高分子纳微球底盘还可作为标准化、工具化的机制探索平台,深入系统地探明疫苗递送的宏观和微观作用机制,如免疫细胞的动态识别与活化以及淋巴结/病灶组织归巢对免疫应答的影响等,从而改变以经验式开发为主的传统疫苗递送研究手段,为预测并合理化设计高效且安全的疫苗递送体系提供理论指导和依据. 上述新策略、新平台和新机制,最终将为疫苗的研发与转化提供安全高效的递送平台与理论支持,推动高分子纳微球制剂相关成果的临床转化和产业发展.
参考文献
32 Mitragotri S, Lahann J. NatMater,2009, 8(1): 15 − 23
33 Sen Gupta A. Wiley Interdiscip Rev NanomedNanobiotechnol, 2016, 8(2): 255 − 270
34 Yang Y, Nie D, Liu Y, Yu M, Gan Y. DrugDiscov Today, 2019, 24(2): 575 − 583
35 Benne N, van Duijn J, Kuiper J, Jiskoot W,Slutter B. J Control Release, 2016, 234: 124 − 34
36 Yue H, Wei W, Fan B, Yue Z G, Wang L Y, MaG H, Su Z G. Pharmacol Res, 2012, 65(2): 189 − 197
37 Jia J, Zhang W, Liu Q, Yang T, Wang L, MaG. MolPharmaceut, 2017, 14(1): 14 − 22
38 Bachmann M F, Jennings G T. Nat RevImmunol, 2010, 10(11): 787 − 96
39 Lv P P, Ma Y F, Yu R, Yue H, Ni D Z, WeiW, Ma G H. Mol Pharmaceut, 2012, 9(6): 1736 − 1747
40 Qiao C M, Liu J D, Yang J, Li Y, Weng J,Shao Y M, Zhang X. Biomaterials, 2016, 85: 1 − 17
41 Ni D Z, Qing S, Ding H, Yue H, Yu D, WangS, Luo N N, Su Z G, Wei W, Ma G H. Adv Sci, 2017, 4(10): 1700083
42 Niikura K, Matsunaga T, Suzuki T,Kobayashi S, Yamaguchi H, Orba Y, Kawaguchi A, Hasegawa H, Kajino K,Ninomiya T,Ijiro K, Sawa H. ACS Nano, 2013, 7(5): 3926 − 3938
43 Chen X M, Liu Y Y, Wang L Y, Liu Y, ZhangW F, Fan B, Ma X W, Yuan Q P, Ma G H, Su Z G. Mol Pharmaceut,2014,11(6): 1772 − 1784
44 Wang Y Q, Wu J, Fan Q Z, Zhou M, Yue Z G,Ma G H, Su Z G. Adv Healthc Mater, 2014, 3(5): 670 − 681
45 Liu Q, Jia J L, Yang T Y, Fan Q Z, Wang LY, Ma G H. Small, 2016, 12(13): 1744 − 1757
46 Wang S, Ni D, Yue H, Luo N, Xi X, Wang Y,Shi M, Wei W, Ma G. Small, 2018, 14(14): e1704272
47 Feng L, Wu L, Qu X. AdvMater,2013, 25(2): 168 − 186
48 Liu Y, Chen C Y, Qian P X, Lu X F, Sun BY, Zhang X, Wang L M, Gao X F, Li H, Chen Z Y, Tang J L, Zhang W J,Dong J Q, BaiR, Lobie P E, Wu Q F, Liu S L, Zhang H F, Zhao F, Wicha M S, Zhu T, Zhao Y L. NatCommun, 2015, 6:5988
49 Lu X, Zhu Y, Bai R, Wu Z, Qian W, Yang L,Cai R, Yan H, Li T, Pandey V, Liu Y, Lobie P E, Chen C, Zhu T. NatNanotechnol,2019, 14(7): 719 − 727
50 Yang K, Feng L Z, Shi X Z, Liu Z. ChemSoc Rev, 2013, 42(2): 530 − 547
51 Yue H, Wei W, Yue Z G, Wang B, Luo N N,Gao Y J, Ma D, Ma G H, Su Z G.Biomaterials, 2012, 33(16): 4013 − 4021
52 Luo N, Ni D, Yue H, Wei W, Ma G H. ACSAppl Mater Interfaces, 2015, 7(9): 5239 − 5247
53 Luo N N, Weber J K, Wang S, Luan B Q, YueH, Xi X B, Du J, Yang Z X, Wei W, Zhou R H, Ma G H. Nat Commun,2017,8: 14537
54 Chen P, Yue H, Zhai X, Huang Z, Ma G H,Wei W, Yan L T. Sci Adv, 2019, 5(6): eaaw3192
55 Yue H, Wei W, Gu Z L, Ni D Z, Luo N N,Yang Z X, Zhao L, Garate J A, Zhou R H, Su Z G, Ma G H. Nanoscale,2015,7(47): 19949 − 19957
56 Bourouina N, Husson J, Hivroz C, Henry N. Langmuir,2012, 28(14): 6106 − 6113
57 Ben M'Barek K, Molino D, Quignard S,Plamont M A, Chen Y, Chavrier P, Fattaccioli J. Biomaterials,2015, 51:270 − 277
58 Xia Y F, Wu J, Wei W, Du Y Q, Wan T, Ma XW, An W Q, Guo A Y, Miao C Y, Yue H, Li S G, Cao X T, Su Z G, Ma G H. NatMater,2018, 17(2): 187 − 194
59 Malissen B, Tamoutounour S, Henri S. Nat RevImmunol, 2014, 14(6): 417 − 428
60 Xia Y, Wu J, Du Y, Miao C, Su Z, Ma G. AdvMater,2018, 30(31): e1801067
61 Hadis U, Wahl B, Schulz O,Hardtke-Wolenski M, Schippers A, Wagner N, Muller W, Sparwasser T, Forster R,Pabst O.Immunity, 2011, 34(2): 237 − 246
关于森辉
中科森辉微球技术(苏州)有限公司于2014年4月设立,位于苏州工业园区的苏州纳米城,是一家集研发、生产、销售于一体的知识驱动型高科技公司,致力为生命科学、生物技术等领域提供国际领先的自主产品以及“一体化”解决方案。公司拥有一支卓越的研发团队和一系列自主知识产权的核心技术。技术团队来自中国科学院,核心灵魂是我国生物材料和生化分离领域的知名专家马光辉研究员和苏志国研究员,以及十多位具有博士学位的技术骨干。
公司的使命是:创造社会效益,为发展高附加值民族产业、改善我国经济结构做出贡献。
公司主营业务包括:
l 制备粒径均一可控的稳定乳液、微球、微囊的膜乳化设备
l 定制乳液、微球、微囊等高附加值产品
l 提供稳定、高效的高流速、高载量层析介质和层析柱
l 提供高流速、超大孔灌注层析介质
l 提供蛋白质纯化系统
l 提供生物制品分离纯化领域的高端整体技术服务





