肿瘤细胞学上的常用实验方法
第一部分:以NCI为代表的药物筛选模式
该筛选模式即NCI基于NCI-60的抗肿瘤药物筛选模式,自1990年起,业界和学术界利用NCI-60细胞已筛选出10万余种化合物,这一方法也是目前肿瘤药物发现领域的中流砥柱。
首先看看它经历的4个发展阶段:
-
1955-1985年:体内筛选模型(in vivo)。以移植性肿瘤动物模型为基础,以动物生命延长率和肿瘤生长抑制率为药物基本评价指标;
-
1985-1990年:体外筛选模型(in vitro)逐渐取代体内模型。即放弃体内小鼠筛选,以人肿瘤细胞株为基础的体外抗肿瘤药物筛选模型。
-
1990-2016年:体外筛选模型(in vitro)为基础。主要是以9大类60种人类肿瘤细胞株NCI-60进行体外筛选;后续在动物体内验证[1];
-
2016年-至今:开始使用来自病人的异种移植肿瘤(PDX)为模型。主要是考虑到NCI-60在体外培养已上千代,可能已产生变异。
然而,PDX模型的建立较为困难且数据库尚不完善,目前我们仍采取以体外细胞株筛选为基础,体内模型后续验证的策略。
基本筛选模型如下图所示:
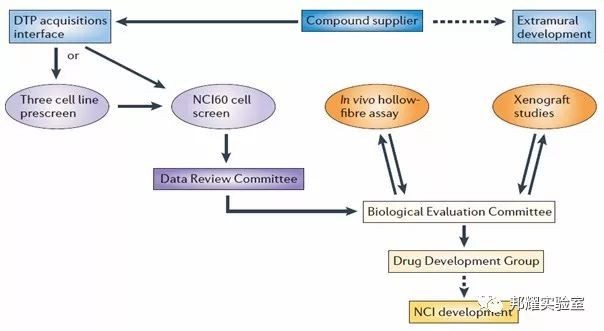 基于NCI-60的药物筛选流程[1]
基于NCI-60的药物筛选流程[1]
筛药流程(基于细胞表型筛选):
-
首先对待筛化合物初筛(3株较敏感的肿瘤细胞株MCF-7; NCI-H460; SF-268),以抑制细胞增殖为指标(3个参数:半生长抑制GI50,总体生长抑制TGI和半致死浓度LC50)。
-
进一步在15-20株肿瘤细胞株(包括耐药细胞株如MCF-7/ADR),正常细胞株等筛选;
-
综合体外结果,在体内模型验证;
-
药物安全性、药代动力学等研究(体内动物水平);
-
根据细胞表型获取相关分子,进行药物作用机制及靶点探究(体外细胞水平为主)。
根据以上NCI筛选模式的发展阶段,我们可以看到以细胞筛选为基础的模式已逐渐成为了必不可少的部分。
细胞筛选模型的主要优势:
-
成本低,操作简单,得到结果快;
-
用药量少,特别是针对取材困难的天然产物;
-
多种人源细胞株同时筛选,可能筛选出对特殊人类肿瘤有效的药物。
细胞实验能得到什么?
-
高通量筛选出候选化合物;
-
初步了解候选化合物的抗瘤谱;
-
为随后进行的体内实验提供参考,如剂量范围、肿瘤类别等 。
常见的细胞实验技术
NCI-60这种筛选模式主要针对未知靶点的药物,一般是基于表型的筛选方法(细胞增殖为主),若是发现药物有较好的抑制细胞生长、转移或血管新生的作用,即可进一步结合动物体内结果验证药效。进而再探索药物的作用靶点[2]。
如铂类抗肿瘤药物,代表药物:顺铂和奥沙利铂
-
首先是发现铂类有很好的抑制多株肿瘤细胞增殖的功能;
-
进一步体内验证有很好的抗多种癌的效果;
-
最后,发现顺铂与DNA结合干扰了正常分裂而杀死癌细胞;进而通过NMR广谱分析单晶的X射线衍射技术确定了铂与DNA碱基结合的位置。
如下图所示,为未知靶点药物的筛选过程:
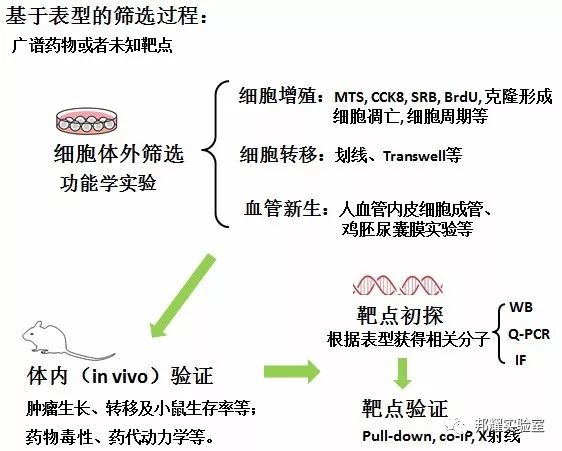
传统的抗癌药物即广谱的化疗药物除了杀伤癌细胞,也会对正常细胞产生影响,如铂类药物具有强烈的肾毒性。因此,21世纪初推动了靶向药物的发展。这类化合物一般是针对某种已知靶点合成可能与靶点结合或者抑制该靶点的化合物,其中以细胞信号转导分子为靶点的抗肿瘤药物占据了大部分:
-
蛋白酪氨激酶抑制剂 代表药物:依马替尼
-
EGFR酪氨酸激酶抑制剂 代表药物:吉非替尼
-
肿瘤新生血管生成抑制药物 代表药物:Avastin
-
法尼基转移酶抑制剂 代表药物:替匹法尼
-
组蛋白去乙酰化酶HDACs抑制剂 代表药物:SAHA(临床阶段)
-
GPCR 代表药物:乳腺癌药物Zoladex
对于这类化合物,一般是先进行靶点验证如酶活实验(明确没有脱靶),再进行细胞相关功能试验,和体内效果验证。与未知靶点药物相比,靶向药物在靶向探索部分,更加快捷和准确,可以直接进行靶点验证。
一般筛选过程如下图所示:
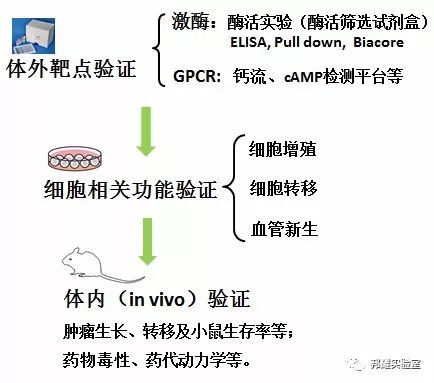
靶向药物筛选流程
如下图为HDACs抑制剂的筛选过程,首先在细胞上验证药物的靶向性,在确定药物的靶点后,进行靶点相关的细胞功能试验,如HDACs与肿瘤细胞生长和分化密切相关,可进行细胞增殖,细胞周期等实验;最后在动物水平验证化合物的抗癌效果。

HDACs抑制剂的筛选过程[3]
本期介绍就到这里了,肿瘤细胞学研究是一个很庞大的工程,今天我们只是从新药研发角度简单介绍了一些常见的细胞生物学上的实验方法,希望大家能给大家带来帮助。
参考文献
1. Shoemaker R H. The NCI60 humantumour cell line anticancer drug screen.[J]. Nature Reviews Cancer, 2006,6(10): 813-823.
2. Swinney D C, Anthony J. How were newmedicines discovered[J]. Nature Reviews Drug Discovery, 2011, 10(7): 507-519.
3. Zhang T, Chen Y, Li J, et al.Antitumor action of a novel histone deacetylase inhibitor, YF479, in breastcancer.[J]. Neoplasia, 2014, 16(8): 665-677.





