基因编辑鼠 sgRNA表达载体构建
在靶点筛选结束之后,下一步就要进行sgRNA载体构建。在构建表达载体前,应根据实验目的选取合适的表达质粒。比如进行实验时考虑是否需要reporter标签,是否需要药物筛选基因等。
接下来以构建px330质粒为例,具体说明如何构建sgRNA表达载体。(图1)
-
先确定20bp靶标序列(基因组序列应为20bp+NGG);
-
如20bp第一个为G,则略过此部分;在20bp前额外添加一个G,形成G+20bp序列(U6 human promoter转录时需要起始碱基为G);
-
在20bp或G+20bp 5’前添加caccg,形成cacc-G+20bp序列,则为Forward序列(直接合成即可);
-
将20bp或G+20bp 进行反向互补,并在5’前添加aaac,则为Reverse序列(直接合成即可);
-
合成的sgRNA正反向碱基(摩尔浓度为100μM)进行退火,使之碱基配对并形成双链结构;
-
BbsI酶切px330质粒,并对酶切后的载体进行回收;
-
将退火配对后的sgRNA碱基用超纯水按1:200稀释,并与回收后的载体进行连接;
-
连接产物进行转化,氨苄抗性固体培养板进行涂板;
-
挑取单克隆菌落,扩大培养后提取质粒,并使用human U6通用引物对连接载体进行测序,检测sgRNA 碱基片段是否正确插入px330质粒。
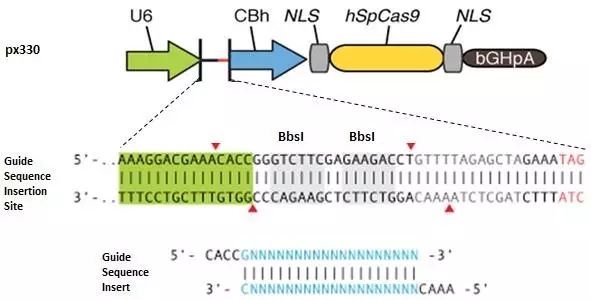
图1.px330 sgRNA表达载体构建示意图
-
确定20bp sgRNA靶序列,按上述操作将其连接至BbsI酶切的pGS3-T7-sgRNA中,测序并挑选正确插入的质粒;
-
pGS3-T7-sgRNA质粒线性化:用DraI酶切1μg pGS3-T7-sgRNA质粒,37℃反应3h;
-
以构建正确的pGS3-T7-sgRNA为模板,配制体外转录反应溶液(体系见表1);
-
将上述溶液均匀混合后轻微离心,将转录反应液收集于反应管底部,42℃反应 2 小时;
-
加3μl RNase-Free DNase I至20μl反应体系中,充分混合后置于37℃反应30min;
-
加77μl RNase-free 纯水以终止反应继续进行;
-
使用酚氯仿和异丙醇方法纯化转录后的RNA;
-
取反应液的一部分进行4% 琼脂糖凝胶电泳,确认体外转录后的 RNA 产物;
-
测定RNA浓度,用以显微注射。

图2. pGS3-T7-sgRNA载体构建及体外转录示意图试剂
用量
Transcription buffer ,10 x
2μl
Template DNA ,200ng/μl
5μl
ATP ,50mM
2μl
GTP ,50mM
2μl
CTP ,50mM
2μl
UTP ,50mM
2μl
Rnase inhibitor ,40U
0.5μl
RNA polymerase , 50U
2μl
RNase-free H2O
2.5μl
表1. sgRNA T7-体外转录反应体系
Cas9表达载体体外转录步骤。(图3)
-
pSP6-Cas9质粒线性化:用NotI单酶切5μg pSP6-Cas9质粒,37℃反应5h;
-
0.8%或1%琼脂糖凝胶电泳,并进行DNA凝胶纯化回收,测定浓度;
-
以纯化DNA为模板,按mMessage mMachine SP6体外转录试剂盒说明书配制反应溶液(体系见表2);
-
将上述溶液均匀混合后轻微离心,将转录反应液收集于反应管底部,37℃反应 2 h;
-
加1μl TURBO DNase至反应溶液中,混匀并在37℃反应15min;
-
加30μl nuclease-free 纯水及30μl 氯化锂溶液,混匀溶液并在-20℃冷冻30min;
-
4℃、14,000g离心10min以沉淀mRNA,小心去除上清溶液。并用500μl 70%乙醇清洗一遍,同时再次4℃、14,000g离心10min;
-
吸净上清乙醇溶液,室温干燥5min,最后用20μl RNase-free 纯水溶解mRNA沉淀,混匀后置冰上并测定浓度,最后置于-80℃或-150℃保存。

图3. pSP6-Cas9载体构建及体外转录示意图
|
试剂 |
用量 |
|
Transcription buffer ,10 x |
2μl |
|
Template DNA ,200ng/μl |
5μl |
|
SP6 NTP/CAP ,2 x |
2μl |
|
SP6 enzyme mix |
2μl |
|
RNase-free H2O |
9μl |
表2. Cas9 mRNA SP6-体外转录反应体系
参考文献:
Shao Y et al., CRISPR/Cas-mediated genomeediting in the rat via direct injection of one-cell embryos. Nat Protoc. 2014Oct;9(10):2493-512.





