知识分享:维真稳转株构建流程
稳转株即稳定表达细胞株,指的是基于某一细胞系构建的持续过表达或干扰某特定基因的细胞系。慢病毒感染-药物筛选法是目前广泛应用的稳转株构建方法,具有高效整合、目标细胞广泛等特点。
一.准备及预实验
- 确定细胞系相关信息,需包括如下内容
|
目标细胞系培养条件 |
|
目标细胞增殖速度 |
|
支原体污染情况 |
注:为避免慢病毒感染后细胞死亡,务必保证细胞无支原体污染!
- 预实验确定MOI值
- 查阅文献确定慢病毒在目标细胞系中的MOI;
- 参考查阅得到的数据,设计梯度实验,摸索最适MOI。
- 预实验确定筛选药物用量:
- 查阅Puromycin/Blastincidin等在目标细胞系中稳转株筛选的致死用量信息;
- 参考查阅得到的数据,确定3个药物浓度梯度(如没有相关信息,则需将药物浓度梯度范围增大,数量增多至6个);
- Day0将细胞铺于6孔板中,使Day1细胞融合度约90%;
- Day1按(2)中设置的药物梯度,加入药物;
- Day4换液,并重新加入药物;
- Day7观察,找到致死率100%的孔,该孔使用的药物浓度,即为药物筛选浓度。
附1:经验筛选药物用量

二.稳转株筛选及构建
注:以下实验参数,按1株稳转株为例描述,实验需考虑有无对照稳转株!
- 细胞铺板:
将细胞接种于6孔板中(4个孔),使次日细胞融合度约70%
- 病毒感染:
根据预实验确定的MOI值,计算慢病毒体积,添加慢病毒(每孔添加ADV-HR 2μL);
- 换液:
慢病毒感染次日,将细胞进行换液处理;
- 观察感染效率:
感染后72小时,观察感染效率,效率最低不应低于40%。
- 筛选:
- 多克隆稳转株:从感染72小时后开始于6孔板中加筛选药物,每隔2天,重新换液加入药物。药物筛选需至少持续14天,直至显微镜下观察荧光细胞比例为100%。
注:第一次加入药物时在上午进行,4-6小时后观察细胞状态,如细胞死亡过多,需更换新鲜不含药物的培养基。
附2:多克隆稳转株

多克隆稳转株的荧光通常强弱夹杂。
- 单克隆稳转株:建立在获得多克隆稳转株基础上
- 有限稀释法:

- 取24个1.5毫升EP管,每管中加入800微升完全培养基;
用胰酶将多克隆稳转株消化(90%融合度,10毫升培养基终止消化),取80微升至第一个EP管中,混合均匀;
注:应使用1000微升枪尖,混合时不要过度吸打,以免破坏细胞。
- 从第一个EP管中取80微升至第二个EP管中,混合均匀,以此类推。
- 将EP管中的细胞悬液,以每孔100微升,接种于96孔板中;
- 过夜培养后,观察第12-24列,寻找只含有1个细胞的孔,并做好标记;
- 培养3-4周,待标记孔中细胞扩增后,消化传代扩增,即为单克隆稳转株细胞。
注:培养的第一周不要换液,接下来每3-4天换液。
- 平板挑取法

- 计数100个多克隆稳转株细胞,接种于一个10cm培养盘中;
注:尽量吹打均匀,防止细胞聚团。
- 过夜培养后,观察并寻找单个细胞的位置,并在盘底做标记;
- 培养培养2周;
注:培养的第一周不要换液,接下来每3-4天换液。
- 待标记处的细胞扩增为肉眼可见的白点,在移液器尖端吸取一点胰酶,缓慢滴至细胞处,待细胞消化后,迅速吹打,将消化下的细胞转移至96孔板中,传代扩增,即为单克隆稳转株细胞。约需2-3周的时间。
注:每盘选取20个为宜,在消化时,需按照先消化边缘的,再消化中心的原则,防止克隆之间的相互污染。培养的第一周不要换液,接下来每3-4天换液。
附3:单克隆稳转株
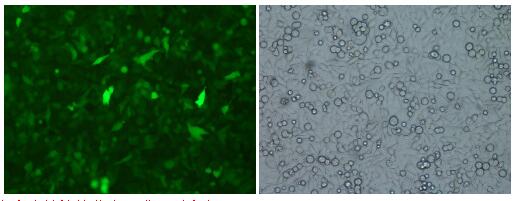
单克隆稳转株的荧光强度基本一致。
三、稳转株构建中的常见问题
1.支原体污染问题
由于轻度的支原体污染并不影响细胞的生长和增殖,故被许多实验室所忽略。但支原体易在病毒感染细胞后爆发,出现大量细胞碎片,甚至导致细胞死亡,导致稳转株筛选的失败。我们建议在稳转株构建之初,务必排除细胞及培养环境中的支原体污染。
2. 其他问题
除支原体污染之外,还有以下问题会经常出现于稳转株构建中。






