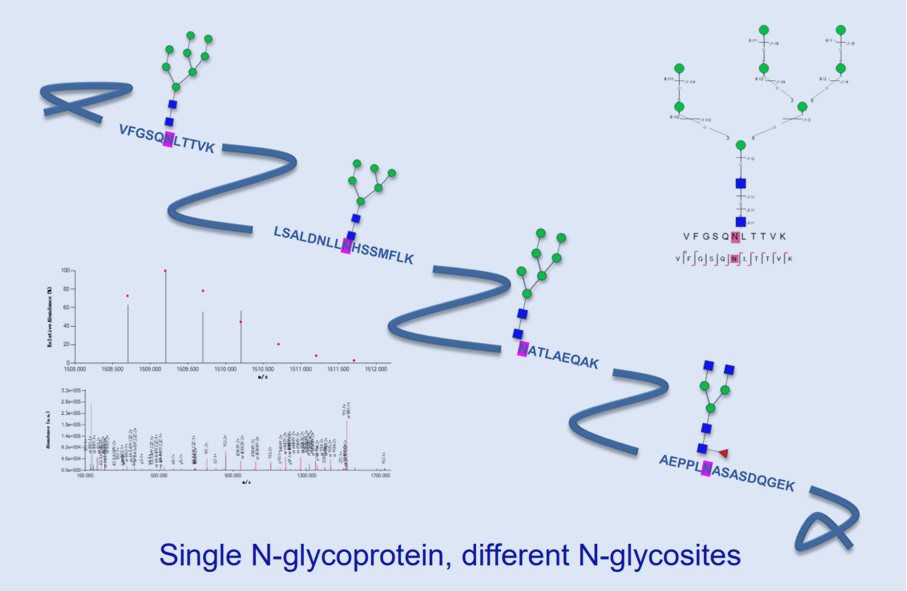
糖基化是在酶的控制下,蛋白质附加上糖类的过程,起始于内质网,结束于高尔基体。 在糖基转移酶作用下将糖转移至蛋白质,和蛋白质上的氨基酸残基形成糖苷键。 真核生物中,一半以上的蛋白质可发生糖基化形成糖蛋白,其中90%是N-糖蛋白。糖基化具有非常重要和广泛的功能:① 对细胞具有保护、稳定及屏障等多方面作用;② 可作为外源性受体的特异性配体,某些糖链可作为各种病毒、细菌及寄生物的特异受体;③ 糖链也可作为内源性受体的特异性配体,介导清除、周转及胞内穿行;④ 糖链在受精过程中也起着重要的作用。
一般情况下,将糖基化修饰分为N- 糖基化和 O-糖基化两种大类:N- 糖基化是指糖链与蛋白质天冬氨酸上的氨基基团通过共价连接而形成的糖蛋白。满足氨基酸序列Asn-X-Thr/Ser/Cys(X≠Pro),具有经典的核心五糖结构(Man3GlcNAc2)。O-糖基化:通过糖苷键与Ser、Thr、羟基赖氨酸(胶原)或Tyr(糖原蛋白)的羟基相连。较短,无核心结构。因此,O-糖基化的糖链结构的解析难度要高于N- 糖基化。同时,糖基化修饰具有宏观和微观不均一性,相同的糖链可以修饰同一蛋白的不同位点,同一位点也可以修饰不同结构的糖链,其解析难度非常大,成为糖基化研究的难点问题。
| 特色糖基化蛋白组学
传统的糖蛋白研究平台,一般通过糖苷酶将聚糖从多肽上切除(要么保留多肽,要么保留糖链),然后通过质谱解析获得多肽上的糖基化修饰位点,或者解析糖链结构。这些策略要么丧失了糖结构信息,要么丢失了多肽位点信息,无法做到糖结构与多肽位点的对应分析,失去了糖基化蛋白组学研究的核心信息。
华盈生物利用酶的特异性,将蛋白切成多肽,并通过富集方法获取含有聚糖的糖肽,利用高能碰撞碎裂质谱将糖肽逐级碎裂,获取质谱各级离子信息。并通过专利质谱数据比对软件和自建的70000条糖肽数据库,对多肽的糖基化位点和糖链结构进行对比分析,既可以保留糖基化位点信息,又可以解析糖的结构,在糖基化对比组学研究中具有独特的优势。
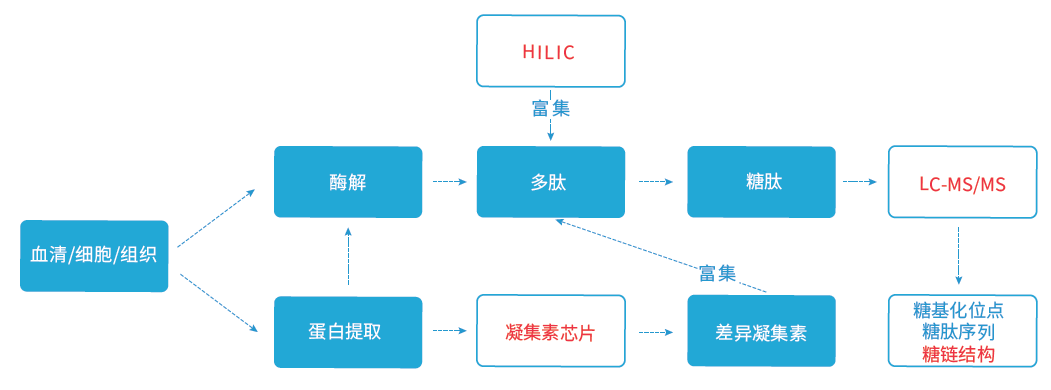
同时,华盈生物还可通过高通量凝集素芯片与糖基化蛋白组质谱技术的组合,完成更为复杂的研究课题。我们可以通过高通量凝集素芯片技术对大批量临床样本中的糖蛋白谱进行差异筛选,找到候选标志物;再对特定凝集素识别的糖蛋白进行糖基化蛋白组质谱解析获得完整的糖谱结构和糖基化位点图谱。

| 数据结果
1. 实验步骤(中英文)
2. 质谱仪采集的原始数据
3. 基于靶向-诱饵库搜索和谱图水平FDR控制的完整N-糖肽IDs的全面鉴定信息,包括多肽骨架(氨基酸序列、潜在N-糖基化位点)和N-连接糖部分(单糖组成、潜在序列和糖苷键连接结构);其中N-糖基化位点进一步得到位点决定性碎片离子确认,序列和连接结构进一步得到结构诊断碎片离子的确认。
4. 差异蛋白生信分析结果
| 样本要求
样本形式:新鲜冷冻组织,FFPE组织,体液(血浆血清、尿液),细胞,完整蛋白,多肽
样本量:动物组织>1 g;植物组织>200 mg;血液样本>1 mL(注意用EDTA防凝);血清>0.5 mL;尿液>2 mL;细胞>5×10^7;酵母/微生物>200 mg
注意要点:尽量避免使用表面活性剂(SDS、Triton-X)和无机盐
| 经典案例
从临床样本中分析发现,乳腺癌在发生发展过程中存在一种叫作平分型GlcNAc的N-糖基化修饰的水平显著下降的现象,并与乳腺癌生存期密切相关。进一步研究发现,侵袭能力较强的乳腺癌细胞分泌的细胞外囊泡上的膜蛋白也低表达平分型GlcNAc修饰。由此提出假设,可能转移能力较弱的乳腺癌细胞(受体细胞)的转移能力会被转移能力较强的乳腺癌细胞(供体细胞)通过分泌外泌体的方式激活。
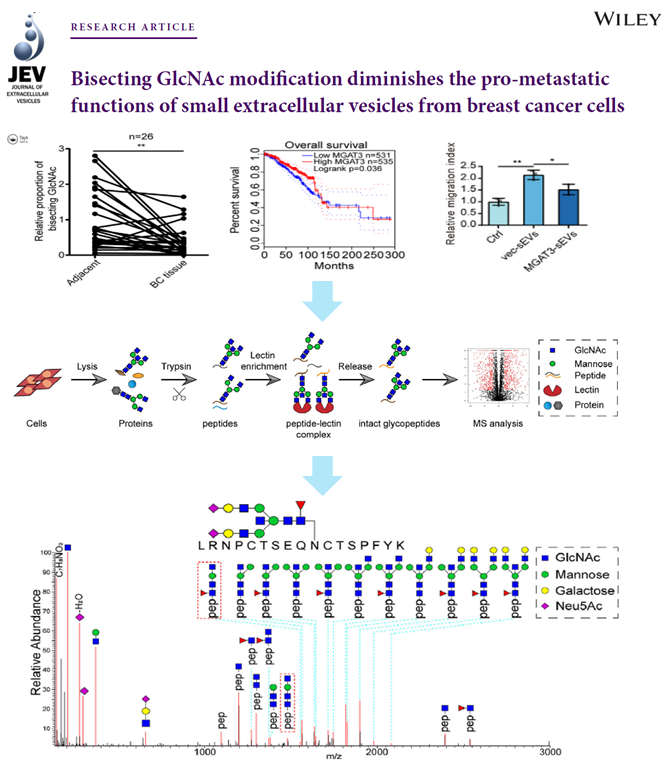
于是,研究人员利用特定凝集素Lectin富集结合质谱分析的策略分析了外泌体处理后的乳腺癌细胞表面糖蛋白的改变,发现细胞膜蛋白integrin β1可能受到平分型GlcNAc修饰的调控。进一步,通过糖基化蛋白组质谱分析,解析了GlcNAc修饰的糖结构,证实了其与integrin β1结合的能力及结合位点。通过阻断实验,得出最终结论:平分型GlcNAc修饰具有通过抑制糖链的延伸,改变蛋白质的糖基化修饰水平,从而影响受体细胞膜蛋白integrin β1及其下游FAK-AKT通路的激活,进而抑制受体乳腺癌细胞侵袭的能力。然而,转移能力较强的乳腺癌细胞均低表达平分型GlcNAc修饰,使得其分泌的外泌体具备了诱导受体乳腺癌细胞加速转移的能力。
| 相关文献
[1]. Xu Junying,Y ang Xuejing, Mao Yong, et al. Removal of N-Linked Glycosylation Enhances PD-L1 Detection in Colon Cancer: Validation Research Based on Immunohistochemistry Analysis. Technol Cancer Res Treat, 2021, 20: 15330338211019442.
[2]. Tan Zengqi, Cao Lin, Wu Yurong, et al. Bisecting GlcNAc modification diminishes the pro-metastatic functions of small extracellular vesicles from breast cancer cells. J Extracell Vesicles, 2020, 10: e12005.
[3]. Jingyun Yang, Wei Wang, Zimin Chen, et al. A vaccine targeting the RBD of the S protein of SARS-CoV-2 induces protective immunity. Nature, 2020, 586: 572–577.
[4]. Wang Yue, Xu Feifei, Chen Yun, et al. A quantitative N-glycoproteomics study of cell-surface N-glycoprotein markers of MCF-7/ADR cancer stem cells.[J] .Anal Bioanal Chem, 2020, 412: 2423-2432.
[5]. Xu Feifei, Wang Yue, Xiao Kaijie, et al. Quantitative site- and structure-specific N-glycoproteomics characterization of differential N-glycosylation in MCF-7/ADR cancer stem cells. Clin Proteomics, 2020, 17: 3.
[6]. Xue Bingbing, Xiao Kaijie, Wang Yue, et al. Site- and structure-specific quantitative N-glycoproteomics study of differential N-glycosylation in MCF-7 cancer cells. J Proteomics, 2020, 212: 103594.