|
Nav1.1-1.8
|
|||||||||||||||||
| [发表评论] [本类其他服务] [本类其他服务商] | ||||||||||||||||||
| 服务商: 北京爱思益普生物科技股份有限公司 | 查看该公司所有服务 >> |
详细说明
表达各种钠离子通道亚型的稳定细胞系信息如下
钠通道稳定表达的HEK293细胞系在含有10% 胎牛血清及1.2mg/ml G418的DMEM培养基中培养,培养温度为37℃,二氧化碳浓度为5%。
细胞传代:除去旧培养基并用PBS洗一次,然后加入1 ml TrypLE? Express溶液,37°C孵育1分钟。当细胞从皿底脱离,加入5 ml 37°C预热的完全培养基。将细胞悬液用吸管轻轻吹打使聚集的细胞分离。将细胞悬液转移至无菌的离心管中,1000rmp离心5分钟收集细胞。扩增或维持培养,将细胞接种于10厘米细胞培养皿,每个细胞培养皿,接种细胞量为3.5*105 cells(最终体积:10 ml)。
为维持细胞的电生理活性,细胞密度必须不能超过80%。
膜片钳检测,实验之前细胞用TrypLE? Express分离,将3*103 细胞铺到盖玻片上,在24孔板中培养(最终体积:500μl),18个小时后,进实验检测。
电生理检测方法
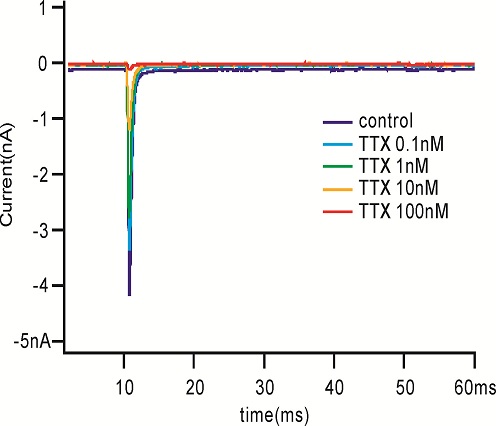
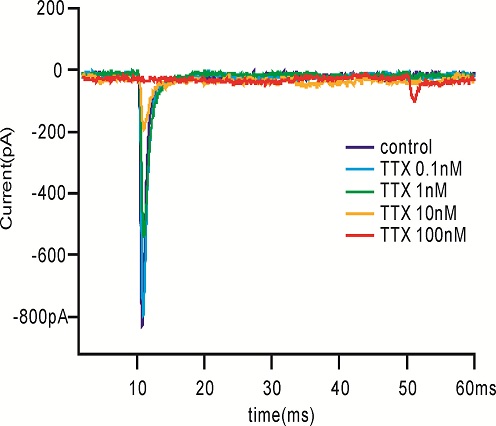
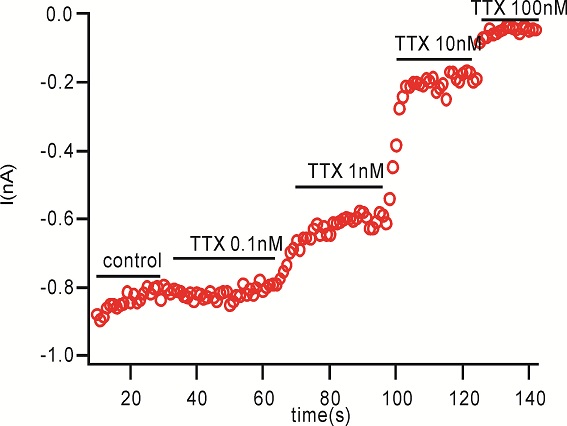
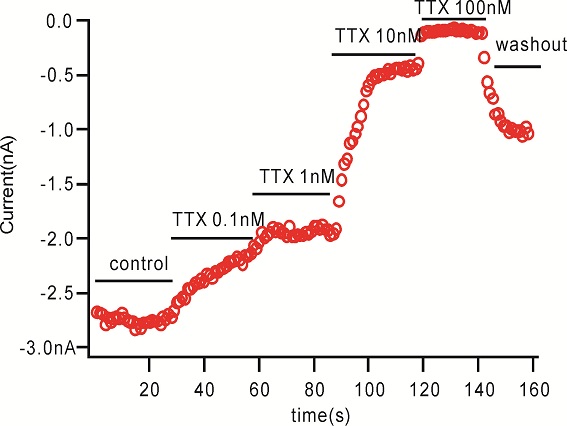
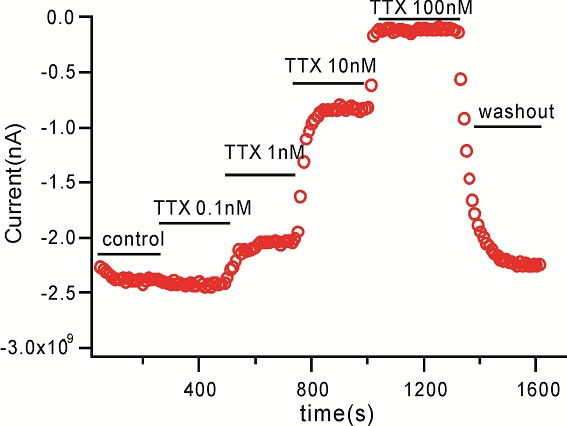
用微电极拉制仪(P97,Sutter Instruments)将毛细玻璃管(BF150-86-10,Sutter Instruments)拉制成记录电极。在倒置显微镜(IX71,Olympus)下操纵微电极操纵仪(MP285,Sutter Instruments)将记录电极接触到细胞上,给予负压抽吸,形成GΩ封接。形成GΩ封接后进行快速电容补偿,然后继续给予负压,吸破细胞膜,形成全细胞记录模式。然后进行慢速电容的补偿并记录膜电容及串联电阻。不给予漏电补偿。当全细胞记录的电流稳定后开始给药,每个药物浓度作用至5分钟后检测下一个浓度,在记录期间独立重复检测多个细胞。所有电生理实验均在室温下进行。实验数据由 EPC-10 放大器(HEKA)进行采集并储存于PatchMaster (HEKA)软件中。
检测实验的刺激方案:

检测化合物对钠离子通道的作用,首先将细胞的膜电位维持在-90mV, 然后去极化到-10mV 持续50ms以激活钠电流. 在整个药物作用中一直运行本刺激方案,具体去极化的电压值在每次测试前由IV曲线的测试获得,会有所调整。
数据质量标准
(1) 串联电阻 ≤ 20 MΩ;
(2) 封接电阻 ≥ 1 GΩ;
(3) 起始电流幅度适宜;
(4) 电流没有明显的自发性衰减(5分钟内自发性衰减小于5%);
(5) 在膜电位为-80mV下无明显的漏电流 (漏电流 ≤ 100 pA)。
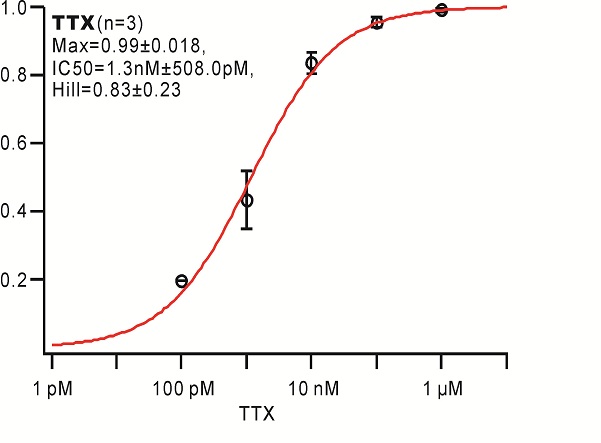
数据分析
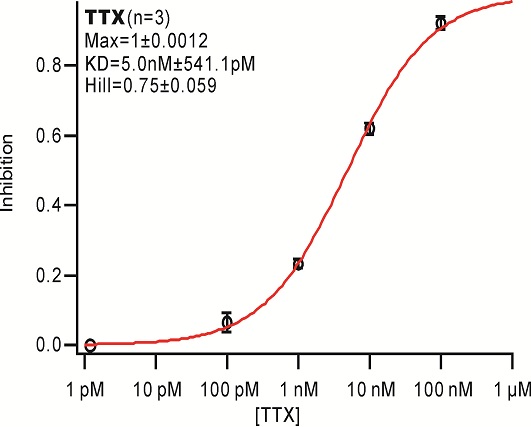
首先将每一个药物浓度作用后的电流和空白对照电流标准化,然后计算每一个药物浓度对应的效应,具体计算方法如下:

ICE NaV channel stable expression cell lines:



2. NaV1.2