|
||||||||||||||||||||||||||||||
| [发表评论] [本类其他产品] [本类其他供应商] [收藏] | ||||||||||||||||||||||||||||||
| 销售商: 上海泽泉科技股份有限公司 | 查看该公司所有产品 >> |
多激发波长调制叶绿素荧光仪Multi-Color-PAM
调制叶绿素荧光分析的终极解决方案,特别适合藻类光合作用测量

在2010年于北京召开的第15届国际光合作用大会上,WALZ公司隆重发布了调制叶绿素荧光研究的鼻祖、首届国际光合作用协会创新大奖得主Schreiber教授的最新产品——多激发波长调制叶绿素荧光仪Multi-Color-PAM。Multi-Color-PAM一经发布就获得了全球光合作用学者的热烈关注,在第15届国际光合作用大会上该产品成为众多国际著名学者驻足参观学习的热点。
Multi-Color-PAM被Schreiber教授称之为“调制叶绿素荧光分析的终极解决方案”,具备6种激发波长的Multi-Color-PAM是最适合各种藻类(包括真核藻类和蓝藻)光合作用深入研究的强大工具。
除了进行藻液、叶绿体等悬浮液测量外,结合一个特别设计的叶夹,Multi-Color-PAM还可以对高等植物叶片(包括其它叶片状样品)进行深入的光合作用测量。
除了经典的调制叶绿素荧光测量(如荧光诱导曲线、快速光曲线等)外,Multi-Color-PAM还具备测量捕光色素蛋白复合体的光学截面积、计算绝对电子传递速率等全新的强大功能,是调制叶绿素荧光领域具有革命性的新技术。
主要功能
- 采用独创的板载芯片LED阵列技术,用6种不同波段的激发光作为测量光、光化光、饱和脉冲、单周转饱和闪光与多周转饱和闪光,对蓝藻、绿藻、硅藻/甲藻、红藻、隐藻等分别提供最适合的光源
- 具备比PAM-2500高200倍的灵敏度
- 最优化设计用于很稀的悬浮液(藻液、叶绿体悬浮液)测量
- 专用叶夹可用于高等植物/大型海藻等叶片状样品的测量
- 标准的PAM测量功能、复杂的多相荧光上升动力学拟合分析、驰豫动力学分析
- 特别适合状态转换研究、“非活性PSII”(“Inactive PS II”)研究(New!)
- 超快时间分辨率达到10 ms,由此利用独特的O-I1相(O-J相)拟合分析用于分析PSII反映中心异质性分析,得出PS II光合单位的连接性参数(p和J),速率常数(Tau)和两种不同类型PS II(Type 1和Type 2)的光学截面积(Sigma)等参数(New!)
- 新增PSII有效光强PAR(II)、经过PSII的绝对电子传递速率ETR(II)l等全新的光合参数。(New!)
- 专业的操作软件,用于复杂的拟合分析


藻类等悬浮液测量用光学单元 叶片状样品测量用特制叶夹
应用领域
主要用于各种藻类的深入光合作用机理研究,用最适合的波长、全新的测量、全新的参数进行蓝藻、绿藻、硅藻、甲藻、红藻、隐藻等的深入研究。
测量参数
Fo, Fm, F, Fm', Fv/Fm, Y(II), qP, qN, NPQ, Y(NO), Y(NPQ), ETR, ETR(II)l, p, J, Tau, Sigma, PAR、PAR(II)等。
Multi-Color-PAM的全新功能介绍
光系统II的相对电子传递速率rETR是很常用的一个参数。rETR= PAR × Y(II) × ETR-factor,其中ETR-factor是指光系统II吸收的光能占总入射PAR的比例。在绝大多数已发表的文献中,均没有试图去测定ETR-factor,只是简单地假定跟“模式叶片”相同,即有50%的PAR分配到光系统II,84%的PAR被光合色素吸收。因此在已有的文献中,rETR一般是用公式rETR=PAR× Y(II) × 0.84 × 0.5来计算的。
近期,利用多激发波长调制叶绿素荧光仪MULTI-COLOR-PAM可以实现光系统II的绝对电子传递速率ETR(II)λ的测量。首先需要利用MULTI-COLOR-PAM测定某个波长下的光系统II功能性光学截面积Sigma(II)λ(单位nm2)(其中λ为波长),然后求出光系统II的量子吸收速率PAR(II)=Sigma(II)λ × L × PAR=0.6022 × Sigma(II)λ× PAR。其中L为阿伏伽德罗常数,系数0.6022是将1 μmol quanta m-2 (即6.022 × 1017quanta-2)转换为0.6022 quanta nm-2,PAR(II)的单位为quanta/(PSII × s)。接下来就可以计算ETR(II)λ=PAR(II) × Y(II)/Y(II)max,其中Y(II)max是经过暗适应达到稳态后的光系统II的量子产量,也就是Fv/Fm×ETR(II)的单位为electrons/(PSII × s)。
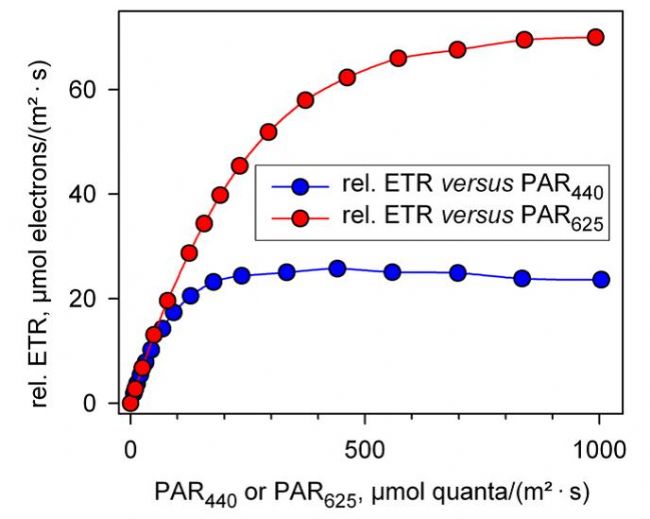
传统的调制叶绿素荧光仪一般只能提供一种或两种颜色的光源,如发出白光的卤素灯、发出蓝光的蓝色LED或发出红光的红色LED等。用不同颜色的光测量的结果可能会有不同,如图1A所示,用蓝光(440 nm)和红光(625 nm)测量绿藻小球藻的快速光曲线有非常显著的差别,蓝光照射下的rETRmax显著小于红光照射下,且在较强的光曲线rETR有轻微下降趋势,这说明蓝光的更容易引发光抑制(Schreiber et al., 2011; Schreiber et al., 2012)。由此可以推测,过去文献报道的很过实验结果,可能会存在由于采用的激发光源不同而引起的错误理解。
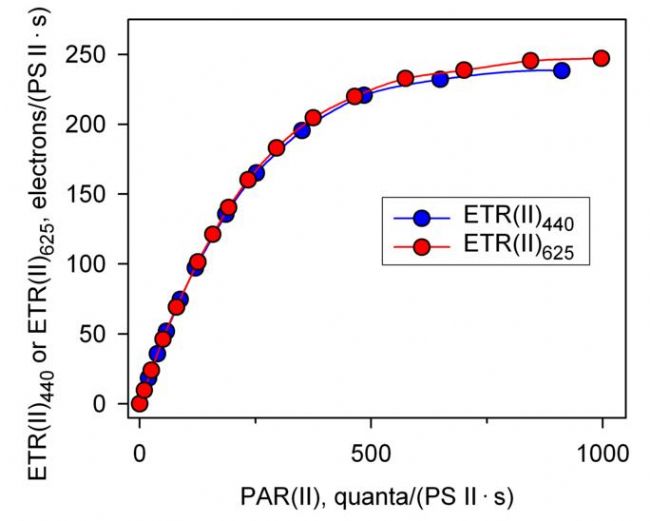
如上文所述,利用最新的MULTI-COLOR-PAM,已经可以测量绝对电子传递速率ETR(II)λ。如果用ETR(II)λ来绘制快速光曲线会出现什么结果呢。图1B是将图8A的结果转换成绝对电子传递速率后得到的结果,可以看出无论是照射蓝光还是照射红光,其绝对电子传递速率是一致的。由此证明图1A中结果的差异是由于不同波长下藻细胞的光系统II功能性光学截面积Sigma(II)λ的大小不同引起的(Schreiber et al., 2011; Schreiber et al., 2012)。这种利用绝对电子传递速率ETR(II)λ绘制的快速光曲线在未来的科研中可能会发挥越来越重要的作用。
 |
 |
|
利用相对电子传递速率(A)和绝对电子传递速率(B)分别绘制的快速光曲线(引自Schreiber et al., 2012) 利用MULTI-COLOR-PAM分别以蓝光(440 nm)和红光(625 nm)作为光化光源,测量小球藻(Chlorella sp.)的快速光曲线。 左图中,rETR的计算采用0.42作为ETR factor。 右图中,蓝光和红光激发下获得的光系统II功能性光学截面积Sigma(II)λ分别为4.547和1.669 nm2,计算绝对电子传递速率ETR(II)440和ETR(II)625的Fv/Fm分别为0.68和0.66。 |
|
产地:德国WALZ
参考文献:
1.Chartrand, K. M., et al. (2018). "Living at the margins–The response of deep-water seagrasses to light and temperature renders them susceptible to acute impacts." Marine environmental research.
2.Li, F., et al. (2018). "Diatom performance in a future ocean: interactions between nitrogen limitation, temperature, and CO2-induced seawater acidification." ICES Journal of Marine Science.
3.Morelle, J., et al. (2018). "Annual Phytoplankton Primary Production Estimation in a Temperate Estuary by Coupling PAM and Carbon Incorporation Methods." Estuaries and Coasts: 1-19.
4.Nikkanen, L., et al. (2018). "Regulation of chloroplast NADH dehydrogenase-like complex by NADPH-dependent thioredoxin system." bioRxiv: 261560.
5.Béchet, Q., et al. (2017). "Modeling the impact of high temperatures on microalgal viability and photosynthetic activity." Biotechnology for Biofuels 10(1): 136.
6.Havurinne, V. and E. Tyystjärvi (2017). "Action spectrum of photoinhibition in the diatom Phaeodactylum tricornutum." Plant and Cell Physiology: pcx156.
7.Kalaji, M. H., et al. (2017). Chlorophyll Fluorescence: Understanding Crop Performance—Basics and Applications, CRC Press.
8.Lamb, J. J. and M. F. Hohmann-Marriott (2017). "Manganese acquisition is facilitated by PilA in the cyanobacterium Synechocystis sp. PCC 6803." PLoS ONE 12(10): e0184685.
9.Li, F., et al. (2018). "Diatom performance in a future ocean: interactions between nitrogen limitation, temperature, and CO2-induced seawater acidification." ICES Journal of Marine Science.
10.Røkke, G., et al. (2017). "The plastoquinone pool of Nannochloropsis oceanica is not completely reduced during bright light pulses." PLoS ONE 12(4): e0175184.
11.Savchenko, T., et al. (2017). "The hydroperoxide lyase branch of the oxylipin pathway protects against photoinhibition of photosynthesis." Planta: 1-14.
12.Shin, W.-S., et al. (2017). "Complementation of a mutation in CpSRP43 causing partial truncation of light-harvesting chlorophyll antenna in Chlorella vulgaris." Scientific Reports 7(1): 17929.



