按品牌选择
|
||||||||||||||||||||||||||||||
| [发表评论] [本类其他产品] [本类其他供应商] [收藏] | ||||||||||||||||||||||||||||||
| 销售商: 北京易科泰生态技术有限公司 | 查看该公司所有产品 >> |
随着荧光光纤氧气测量技术的问世,精确、高通量测量微小生物如藻类等浮游植物、浮游动物、鱼卵胚胎、斑马鱼等水生微小生物或组织的的呼吸与能量代谢成为可能。荧光光纤氧气测量技术具有超短反应时间、高精确度和高可靠性、适用于气相和液相等优势,在实验生物学研究、污染生态学与环境毒理学、环境科学与气候变化研究等领域具有越来越重要的应用价值。

系统由内置荧光光纤氧气传感器的封闭式孔多孔板、氧气测量主机模块及在线数据采集分析软件组成,可对24个、96个乃至最多240个通道的样品进行同步测量。
功能特点
氧气测量高精度、高可靠性、低功耗、低交叉敏感性、快速响应时间
技术参数
1. ×24通道高通量呼吸测量系统
2. ×96通道高通量呼吸测量系统
2.1 REDFLASH技术:基于独特的分析物敏感REDFLASH传感器材料,以红光激发并在近红外(NIR)区域显示分析物依赖的发光。
2.2 技术优势:红光激发显著减少了由自发荧光样品引起的干扰。NIR检测技术显著减少了与环境光的干扰。
2.3 可选氧气传感器类型:薄膜贴或者纳米颗粒。
2.4 薄膜贴直径约为1-1.5毫米,固定在孔底中心,无光学隔离。
2.5 配套采集软件:新一代用户友好且多功能的采集软件,可在同一个窗口管理多达3台设备。
应用案例
浮游植物细胞光合放氧和呼吸作用测定
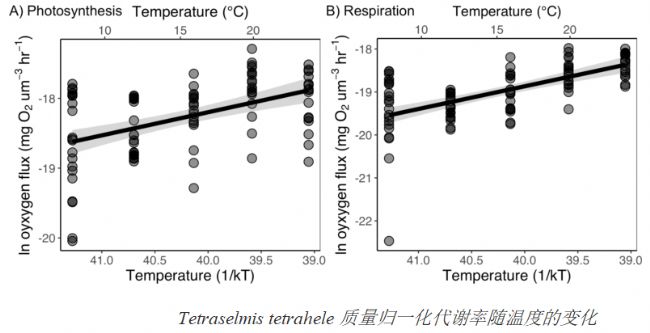
2017年,不列颠哥伦比亚大学的Bernhardt适用200mL的高通量呼吸系统测量了浮游植物细胞光下的放氧量及黑暗条件下的氧气消耗量,用以计算其质量归一化代谢率(氧通量/总细胞体积)和光合作用的活化能。实验中使用了透明的PCR膜密封呼吸室,在3小时内每隔15秒测量一次氧气浓度。
鱼类胚胎呼吸代谢测量2017年,美国加利福尼亚大学的Flynn和Todgham采用高通量呼吸测量技术,对发育的南极鱼代谢活动进行了测量和分析(下图)。

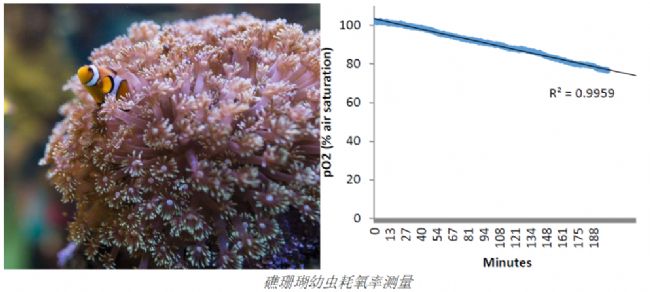
珊瑚幼虫耗氧率测定美国海洋和大气管理和研究局的(NOAA)Xaymara Serrano等(2018)使用200微升的高通量呼吸系统测量了两个物种的加勒比礁珊瑚幼虫的耗氧率(参见下图)。研究团队的成员来自位于迈阿密的大西洋海洋和气象实验室以及迈阿密大学海洋与大气学院,他们研究了多种因子(如温度、硝酸盐富集)对幼虫的活动的影响,研究结果刊登在《Coral Reefs》杂志上,并在论文里详细介绍了他们是如何使用该技术测量如此微小的生物的耗氧率。
参考文献

系统由内置荧光光纤氧气传感器的封闭式孔多孔板、氧气测量主机模块及在线数据采集分析软件组成,可对24个、96个乃至最多240个通道的样品进行同步测量。
功能特点
氧气测量高精度、高可靠性、低功耗、低交叉敏感性、快速响应时间
- 轻松校准
- 气体、液体样品均可使用
- 非侵入性和非破坏性测量
- 紧凑的设计,适用于温控培养箱和/或摇床
技术参数
1. ×24通道高通量呼吸测量系统
- 检测技术:光纤氧传感器技术。
- 适用场景:原位检测,可在培养箱里或摇床上使用,便于温度控制。
- 呼吸室:硼硅酸盐玻璃材质的24孔板,每孔容积80-1,700 µl。可使用酒精轻松清洗、重复使用。
- 读取器:单个重380g,163 x 89 x 22 mm;可1-10个进行组合。
- 氧气测量范围:0-50%或0~22.5mg/l
- 检测极限:0.15%或15ppb溶解氧
- 氧气测量精度:±1%@20.9%氧气。
- 氧气测量分辨率:±0.4%@20.9%氧气或±5μmol@283.1µmol
- 响应时间:<30s
- 氧气测量漂移:<1%空气饱和度(一周/10min采集一次)
- 通道数:最多可串联10个读取器,形成240个通道

2. ×96通道高通量呼吸测量系统
2.1 REDFLASH技术:基于独特的分析物敏感REDFLASH传感器材料,以红光激发并在近红外(NIR)区域显示分析物依赖的发光。
2.2 技术优势:红光激发显著减少了由自发荧光样品引起的干扰。NIR检测技术显著减少了与环境光的干扰。
2.3 可选氧气传感器类型:薄膜贴或者纳米颗粒。
2.4 薄膜贴直径约为1-1.5毫米,固定在孔底中心,无光学隔离。
2.5 配套采集软件:新一代用户友好且多功能的采集软件,可在同一个窗口管理多达3台设备。
- 配套分析软件:提供耗氧率计算和漂移补偿等数据分析的功能。
- 呼吸室:圆底(270 μL)或平底(350 μL)孔的透明聚苯乙烯多孔板,支持预消毒(EtO环氧乙烷)处理。

应用案例
浮游植物细胞光合放氧和呼吸作用测定
2017年,不列颠哥伦比亚大学的Bernhardt适用200mL的高通量呼吸系统测量了浮游植物细胞光下的放氧量及黑暗条件下的氧气消耗量,用以计算其质量归一化代谢率(氧通量/总细胞体积)和光合作用的活化能。实验中使用了透明的PCR膜密封呼吸室,在3小时内每隔15秒测量一次氧气浓度。

鱼类胚胎呼吸代谢测量2017年,美国加利福尼亚大学的Flynn和Todgham采用高通量呼吸测量技术,对发育的南极鱼代谢活动进行了测量和分析(下图)。

珊瑚幼虫耗氧率测定美国海洋和大气管理和研究局的(NOAA)Xaymara Serrano等(2018)使用200微升的高通量呼吸系统测量了两个物种的加勒比礁珊瑚幼虫的耗氧率(参见下图)。研究团队的成员来自位于迈阿密的大西洋海洋和气象实验室以及迈阿密大学海洋与大气学院,他们研究了多种因子(如温度、硝酸盐富集)对幼虫的活动的影响,研究结果刊登在《Coral Reefs》杂志上,并在论文里详细介绍了他们是如何使用该技术测量如此微小的生物的耗氧率。

参考文献
- Glass, B.H., Jones, K.G., Ye, A.C., Dworetzky, A.G., Barott, K.L., 2023. Acute heat priming promotes short-term climate resilience of early life stages in a model sea anemone. PeerJ 11, e16574.
- Göpel, T., Burggren, W.W., 2024. Temperature and hypoxia trigger developmental phenotypic plasticity of cardiorespiratory physiology and growth in the parthenogenetic marbled crayfish, Procambarus virginalis Lyko, 2017. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology 288, 111562.
- Kämmer, N., Reimann, T., Ovcharova, V., Braunbeck, T., 2023. A novel automated method for the simultaneous detection of breathing frequency and amplitude in zebrafish (Danio rerio) embryos and larvae. Aquatic Toxicology 258, 106493.
- Karlsson, K., Søreide, J.E., 2023. Linking the metabolic rate of individuals to species ecology and life history in key Arctic copepods. Mar Biol 170, 156.
- Mathiron, A.G.E., Gallego, G., Silvestre, F., 2023. Early-life exposure to permethrin affects phenotypic traits in both larval and adult mangrove rivulus Kryptolebias marmoratus. Aquatic Toxicology 259, 106543.
- Pettersen, A.K., Metcalfe, N.B., Seebacher, F., 2024. Intergenerational plasticity aligns with temperature-dependent selection on offspring metabolic rates. Philosophical Transactions of the Royal Society B: Biological Sciences 379, 20220496.
- Powers, M.J., Baty, J.A., Dinga, A.M., Mao, J.H., Hill, G.E., 2022. Chemical manipulation of mitochondrial function affects metabolism of red carotenoids in a marine copepod (Tigriopus californicus). Journal of Experimental Biology 225, jeb244230.
- Ricarte, M., Prats, E., Montemurro, N., Bedrossiantz, J., Bellot, M., Gómez-Canela, C., Raldúa, D., 2023. Environmental concentrations of tire rubber-derived 6PPD-quinone alter CNS function in zebrafish larvae. Science of The Total Environment 896, 165240.
- Scovil, A.M., Boloori, T., de Jourdan, B.P., Speers-Roesch, B., 2023. The effect of chemical dispersion and temperature on the metabolic and cardiac responses to physically dispersed crude oil exposure in larval American lobster (Homarus americanus). Marine Pollution Bulletin 191, 114976.
- Varshney, S., Lundås, M., Siriyappagouder, P., Kristensen, T., Olsvik, P.A., 2024. Ecotoxicological assessment of Cu-rich acid mine drainage of Sulitjelma mine using zebrafish larvae as an animal model. Ecotoxicology and Environmental Safety 269, 115796.
手机版:高通量水生生物呼吸代谢测量系统
Copyright(C) 1998-2025 生物器材网 电话:021-64166852;13621656896 E-mail:info@bio-equip.com




