开年上新:尚恩生物细胞转染服务正式上线啦!
01 细胞转染概述及应用
细胞转染是指将外源的基因如DNA、RNA等采用各种化学、生物学或物理方法导入真核细胞的技术。是生物医学研究的重要工具,广泛应用于以下方面:
■研究基因功能
通过导入特定研究的目的基因,使目的基因过表达,研究其在细胞中的高表达情况下细胞功能的影响。或者利用siRNA或shRNA使目的基因不表达或者表达降低,研究基因缺失情况下对细胞功能的影响。
■蛋白质表达生产
通过转染编码所需目的蛋白的基因,进行蛋白质表达及纯化,也可以通过融合荧光蛋白,研究目的蛋白在细胞内的分布或者定位。
■细胞工程
通过转染和筛选,获得能够稳定表达外源基因的细胞系,即构建稳转细胞株。
■药物筛选与毒性测试
转染特定基因,从而验证药物靶点的有效性。通过高通量筛选,筛选出潜在药物。
■基因治疗
导入或者修复基因,治疗一些遗传病,也可转染编码抗原基因,进行疫苗研发。
02 细胞转染分类
Part.1
按导入的核酸存在于宿主细胞的时间长短,分为瞬转和稳转。
瞬转:外源基因得以表达但它们并不会整合到宿主细胞的基因组中,随细胞分裂逐渐丢失。
稳转:外源基因能够整合到细胞的基因组中,随细胞分裂持续表达,使得转染细胞的子代细胞也同样表达外源基因。
二者区别:
|
区别 |
瞬转 |
稳转 |
|
目的不同 |
短时间获得高水平的基因表达 |
获得稳定表达目的基因的细胞株 |
|
稳定性不同 |
瞬时转染由于基因未整合到染色体体,稳定性较差
|
由于经过筛选,目的基因整合到染色体中,其稳定性好 |
|
方法不同 |
一般采用脂质体转染法
|
一般更偏向于病毒转染、电转等方法 |
|
筛选过程不同 |
转染后一般不需要进行筛选
|
一般需要经过筛选,挑选出目的基因整合到宿主染色体中的细胞 |
|
质粒不同 |
质粒不需要带有抗性
|
一定要带有特定的抗性以便于后续的克隆株筛选 |
|
表达时效不同 |
目的基因的表达通常持续几天,不能稳定遗传
|
长时间稳定表达目的基因 |
|
实验周期不同 |
转染后24h-96h收细胞 |
2-3周甚至3-4周筛选出稳转细胞克隆 |
Part.2
按照方法分为物理介导法、化学介导法,生物介导法。
物理介导法:通过物理的方法(例如电穿孔法、显微注射法)直接将外源核酸导入到细胞内,一般不需要使用任何化学物质。效率较高,但对细胞损伤大,细胞存活率低。
化学介导法:通过使用一些化学物质,如PEI、脂质体等,来改变细胞膜的物理和化学性质,使其对外源性DNA或RNA具有亲和力,从而实现基因转移。这种方法实验操作简单,周期短,但大多数不能长期稳定表达外源基因。
生物介导法:一般利用病毒作为载体,将外源基因包装后导入细胞,如慢病毒、腺病毒、逆转录病毒。这种方法可以实现外源基因的长期稳定表达,也可进行体内、体外高效、特异性的基因转移。但实验操作较为繁琐,实验周期较其他方法长。
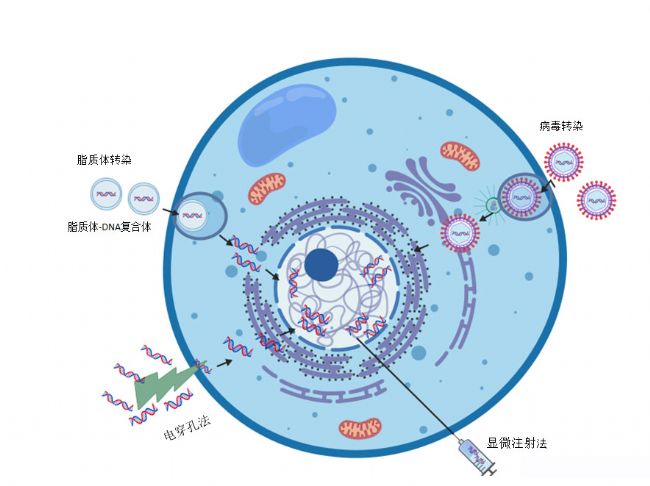
由此看来,细胞转染方法多种多样。选择哪种转染方法,取决于实验需求、实验室条件、细胞的类型和转染效率等因素。
目前,大多数实验室使用较多的主要有化学介导中的脂质体转染(质粒转染)和生物介导中的慢病毒转染法。质粒转染操作简单,但有些细胞系不容易转染,转染效率低,给实验带来很多不便。而病毒转染具有能够稳定表达,宿主范围广的优势,且其对非分裂的原代细胞、干细胞等具有较高的转染效率,同时体内外实验均有效,同样适用于体内活体动物实验,如动物成瘤等。
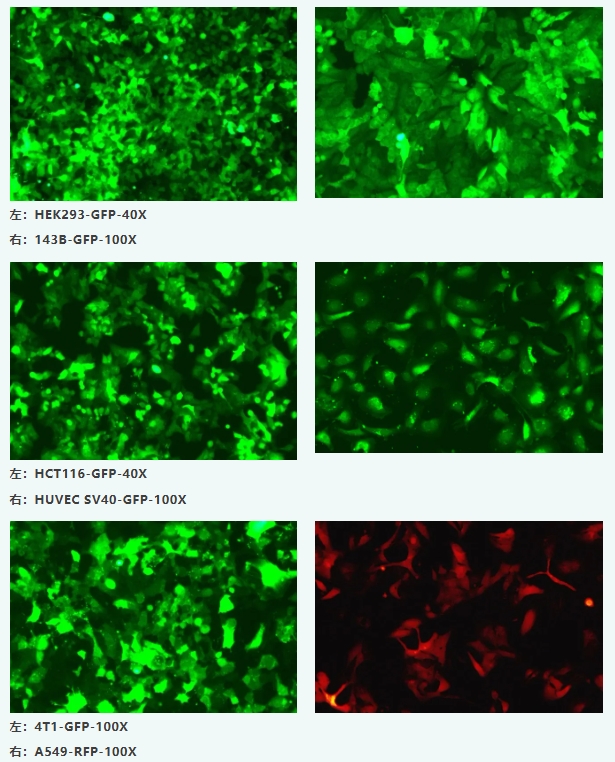
我们尚恩生物公司对常用的细胞系,原代细胞进行慢病毒转染,包括细胞慢病毒转染绿色荧光蛋白(ZsGreen)或者红色荧光蛋白(mCherry、RFP)、细胞慢病毒转染化学发光LUC、细胞慢病毒SV40永生化转染,总共近40种稳转细胞系。也可以进行指定细胞的慢病毒转染。
✔ 慢病毒转染服务
|
服务 编号 |
转染类别 |
试验目标 |
实验周期 |
|
SNTS-L001 |
GFP稳转 |
获得GFP稳定表达的细胞 |
3-4周 |
|
SNTS-L002 |
RFP稳转 |
获得RFP稳定表达的细胞 |
3-4周 |
|
SNTS-L003 |
mCherry稳转 |
获得mCherry稳定表达的细胞 |
3-4周 |
|
SNTS-L004 |
LUC稳转 |
获得LUC稳定表达的细胞 |
3-4周 |
|
SNTS-L005 |
SV40永生 |
获得SV40永生化的细胞(以原代细胞为主) |
6-8周 |
武汉尚恩生物简介:
武汉尚恩生物技术有限公司坐落于武汉东湖高新区光谷生物城,专注于细胞及系列产品的研发、生产和服务,公司建有标准化GMP实验室、动物房,已通过GB/T19001-2016/ISO9001:2015质量管理体系认证,并获得高新技术企业等多项荣誉。
公司主要研发生产细胞系、原代细胞、胎牛血清、基础培养基、完全培养基、辅助试剂等系列产品,提供细胞及培养配套产品一站式采购服务;细胞库储存细胞系700余种,同时通过不间断引种细胞扩大丰富细胞种类;公司还提供人源、小鼠源细胞系的STR鉴定,其他种属细胞的种属鉴定服务,细胞标志物检测,污染检测等细胞相关实验服务。
尚恩生物细胞类产品为国内各大高校生物实验室、医学院、生物研究机构及相关诊断、制药公司等提供完善的细胞资源库和相关配套试剂,公司将不断追求卓越产品品质为广大科研工作者提供更优质的产品和服务!尚恩生物 — 您专业的细胞供应商!
- 西藏药检所成功引进Phenom XL大仓室智能扫描电镜
- 易科泰FMT150藻类培养与监测系统落户天津大学
- 因美纳推出全新空间转录组学技术
- 2025瑞孚迪全球销售启动大会在拉斯维加斯圆满举行
- 国货当自强!微纯国产替代色谱图有奖征集活动开始啦
- 赛恩深度参与电子测量仪器产业及标准化研究报告编制
- 真迈生物再次获批“十四五”国家重点研发计划
- 科圣科技拿下Diagnostic Biochips中国区总代理
- 科德角国际获北京市专精特新与创新型中小企业认证
- 天隆联合西安交大共同推进的国家医学中心正式启动
- 富勒Fuller Laboratories加入兽医诊断领导者VMRD
- 华中科技大学与泰渡生物共建蛋白纯化示范实验室
- 棱镜泰克携手许川教授团队研制的新款流式细胞仪获证
- 华大智造副总裁中国区总经理彭欢欢一行到访伯豪生物
- 因美纳被列入不可靠实体清单,国产替代,谁是最优解
- 开年上新:尚恩生物细胞转染服务正式上线啦!
- 尚恩生物开年大促销,福利叠满解锁新学期!
- 尚恩生物年终大促—4款细胞系套餐送500ml完全培养基
- 尚恩生物双11促销:任意细胞系+配套完培下单立减100
- 赛业今晚直播:点突变细胞株构建策略及其研究应用
- 赛业讲座:两步灌流法提取原代鼠肝脏Kupffer细胞
- 赛业生物课程预告:基因编辑细胞技术及其研究应用
- 赛业生物明日开播:CAR-T细胞的结构设计策略
- 尚恩生物细胞特价—30株细胞系限时890元/株
- 尚恩生物——胎牛血清、原代细胞福利大放送
- 尚恩生物6月促销:1380元超值宠粉细胞套装限时购
- 科德角国际正式成为ATCC菌株产品中国授权合作商
- 赛业生物课程预告:星形胶质细胞培养和应用
- 美森细胞与您相约2024中国衰老科学大会
- 美森细胞即将亮相BPCF第五届北京生物药工艺开发大会






